2023-2024学年北京师大附属实验中学高三(上)开学化学试卷
发布:2024/8/26 4:0:8
一、本部分共14题,每题3分,共42分。在每题列出的四个选项中,选出最符合题目要求的一项。
-
1.下列化学用语正确的是( )
组卷:11引用:2难度:0.7 -
2.NA为阿伏加德罗常数,下列说法正确的是( )
组卷:27引用:3难度:0.7 -
3.根据元素周期律判断,不正确的是( )
组卷:8引用:3难度:0.8 -
4.元素周期表中的五种元素A、B、E、W、Z,原子序数依次增大。A的基态原子价层电子排布为nsnnpn;B的基态原子最外层有3个单电子;E的原子最外层电子数是其内层的3倍,W和E位于同一族;Z3+的3d轨道中有5个电子。下列说法正确的是( )
组卷:25引用:2难度:0.5 -
5.下列各组变化,所克服的粒子间作用属于同种类型的是( )
组卷:6引用:2难度:0.7 -
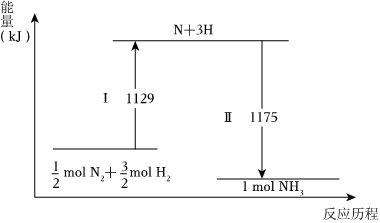 6.N2(g)与H2(g)在铁催化剂表面经历如图过程生成NH3(g),下列说法不正确的是( )组卷:42引用:2难度:0.5
6.N2(g)与H2(g)在铁催化剂表面经历如图过程生成NH3(g),下列说法不正确的是( )组卷:42引用:2难度:0.5
第二部分非选择题(共58分)
-
18.用ClO2消毒的饮用水中会含有ClO2、
和ClO-2,化学小组用如下方法测定预处理后的饮用水中ClO2、ClO-3和ClO-2的含量和总量(总氯)。ClO-3
资料:氧化性强弱:ClO2>>ClO-2;I2+2Na2S2O3═2NaI+Na2S4O6(Na2S2O3和Na2S4O6溶液颜色均为无色)ClO-3
Ⅰ.ClO2和含量的测定ClO-2
①向v1mL的饮用水中加入过量KI溶液,用amol/L Na2S2O3标准溶液滴定至终点。消耗Na2S2O3溶液v2mL;
②向①中反应后的溶液中,加入盐酸调节溶液pH=2,充分反应后,继续用amol/L Na2S2O3标准溶液滴定至终点,又消耗Na2S2O3溶液v3mL。
Ⅱ.总氯的测定
③向v1mL的饮用水中加入过量KBr溶液,加入浓盐酸调节溶液pH=0.5,密封放置20min;然后加入过量KI溶液,立即用饱和磷酸氢二钠溶液调节溶液pH=1.5。
④用amol/L Na2S2O3标准溶液滴定至终点,消耗Na2S2O3溶液v4mL。
⑤用v1mL的纯水重复③~⑤,消耗Na2S2O3溶液v5mL。
(1)配制vmL amol/L Na2S2O3标准溶液,需称量Na2S2O3固体g。
(2)①中滴定时所用的指示剂应该是,滴定至终点的现象是。
(3)②中加入盐酸后发生反应的离子方程式是。
(4)磷酸氢二钠(Na2HPO4)溶液呈碱性的原因是。(结合离子方程式和必要的文字说明)
(5)③中加入KI后发生反应的化学方程式是。
(6)水样中的含量是ClO-3mg/L。
(7)测定总氯时不用KI直接反应,而是先加入KBr的原因是。组卷:9引用:2难度:0.5 -
19.某同学研究浓硝酸与KSCN溶液的反应。
资料:Ⅰ.SCN-中S、C、N元素的化合价依次为:-2价、+4价、-3价。
Ⅱ.SCN-的性质类似卤素离子,能被氧化为黄色的(SCN)2,(SCN)2可聚合为红色的(SCN)x。
Ⅲ.NO2可溶于浓硝酸。
实验一: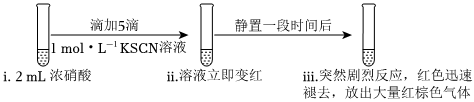
(1)向浓硝酸中滴加KSCN溶液,溶液立即变红是因为生成了。(填化学式)
(2)研究SCN-的转化产物。
实验二:
a.将实验一ⅲ中的气体通入Ba(OH)2和NaOH的混合溶液中,有白色沉淀生成。
b.过滤、洗涤白色沉淀,取少量于试管中,加入过量的稀硝酸,沉淀完全溶解,再滴加少量KMnO4溶液,不褪色。
c.另取少量实验一ⅲ中试管内的溶液加入BaCl2溶液,产生大量白色沉淀。
①通过b证实了红棕色气体中不含SO2,证据是。
②a中,Ba(OH)2溶液中加入NaOH溶液以增大OH-浓度的目的是。
③由上述实验现象可知:SCN-转化的最终产物中一定有。
(3)继续研究实验一ⅲ中“静置一段时间后,突然剧烈反应,红色迅速褪去”的原因。
实验三: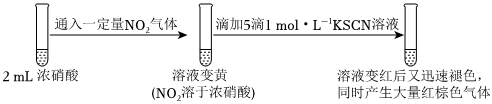
①对比实验一和实验三可得结论:一定浓度的NO2。
②结合实验三,从化学反应速率的角度解释实验一ⅱ和ⅲ中的现象:。组卷:123引用:7难度:0.6


