2022-2023学年黑龙江省牡丹江一中高二(上)期中化学试卷
发布:2024/9/20 5:0:9
一、选择题(单项选择题,每小题2分,共46分)
-
1.下列电解质在水溶液中电离方程式正确的是( )
组卷:4引用:1难度:0.5 -
2.已知下列事实,其中与盐类的水解有关的有( )
①NaHSO4溶液呈酸性;
②长期施用化肥(NH4)2SO4会使土壤酸性增强,发生板结;
③配制CuCl2溶液时,用稀盐酸溶解CuCl2固体;
④NaHS溶液中c(H2S)>c(S2-);
⑤氯化铵溶液可去除金属制品表面的锈斑;
⑥蒸干FeCl3溶液,往往得不到FeCl3固体。组卷:46引用:3难度:0.6 -
3.NH3的氧化还原反应为4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)ΔH<0,下列图象不正确的是( )
组卷:29引用:3难度:0.5 -
4.向密闭容器中充入1molHI,发生反应:2HI(g)⇌H2(g)+I2(g)ΔH>0,达到平衡状态。该反应经过以下两步基元反应完成:ⅰ.2HI→H2+2I•ΔH1ⅱ.2I•→I2ΔH2。下列分析不正确的是( )
组卷:19引用:5难度:0.5 -
5.向浓度为0.1mol⋅L-1NaF溶液中不断加水稀释,下列各量增大的是( )
组卷:2引用:1难度:0.7 -
6.已知Ksp(AgCl)=1.78×10-10,Ksp(Ag2CrO4)=2.00×10-12.在只含有KCl、K2CrO4的混合溶液中滴加0.001mol•L-1的AgNO3溶液,当AgCl与Ag2CrO4共存时,测得溶液中
的浓度是5.000×10-3 mol•L-1,此时溶液中Cl-的物质的量浓度是( )CrO2-4组卷:30引用:5难度:0.7 -
7.由合成气制备二甲醚的主要原理如下.下列有关说法正确的是( )
①CO(g)+2H2(g)⇌CH3OH(g)△H1=-90.7kJ•mol-1
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H2=-23.5kJ•mol-1
③CO(g)+H2O(g)⇌CO2(g)+H2(g)△H3=-41.2kJ•mol-1.组卷:9引用:4难度:0.7 -
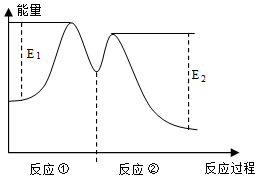 8.一定温度下,向10mL0.40mol/LH2O2溶液中加入适量FeCl3溶液,不同时刻测得生成O2的体积(已折算为标准状况)如下表所示。
8.一定温度下,向10mL0.40mol/LH2O2溶液中加入适量FeCl3溶液,不同时刻测得生成O2的体积(已折算为标准状况)如下表所示。
资料显示,反应分两步进行:①2Fe3++H2O2═2Fe2++O2↑+2H+,②H2O2+2Fe2++2H+═2Fe3++2H2O,反应过程中能量变化如图所示。下列说法不正确的是( )t/min 0 2 4 6 V(O2)/mL 0 9.9 17.2 22.4 组卷:4引用:1难度:0.5 -
9.下列事实中,能说明MOH是弱碱的有( )
①0.1mol/LMOH溶液可以使酚酞试液变红
②常温下,0.1mol/LMOH溶液中c(OH-)<0.1mol/L
③常温下,0.1mol/LMOH溶液的导电能力比0.1mol/LNaOH溶液弱
④0.1mol/L的MOH溶液与等体积0.1mol/L的盐酸恰好完全反应
⑤常温下,往MCl溶液中滴加石蕊溶液,溶液呈浅红色组卷:20引用:2难度:0.7
二、填空题(共54分)
-
26.二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂,实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2:
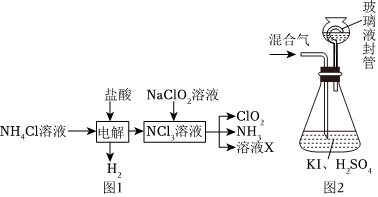
用如图2装置可以测定混合气中ClO2的含量:
Ⅰ.在锥形瓶中加入足量的碘化钾,用50mL水溶解后,再加入3mL稀硫酸;
Ⅱ.在玻璃液封装置中加入水,使液面没过玻璃液封管的管口;
Ⅲ.将一定量的混合气体通入锥形瓶中吸收;
Ⅳ.将玻璃液封装置中的水倒入锥形瓶中;
Ⅴ.用0.1000mol•L-1硫代硫酸钠标准溶液滴定锥形瓶中的溶液(I2+2S2=2I-+S4O2-3),指示剂显示终点时共用去20.00mL硫代硫酸钠溶液。O2-6
(1)写出溶液X中溶质的化学式。
(2)锥形瓶内ClO2与碘化钾反应的离子方程式为。
(3)玻璃液封装置的作用是。
(4)V中加入的指示剂通常为,滴定至终点的现象是。
(5)测得混合气中ClO2的质量为g。
(6)若步骤Ⅱ中液面没有没过玻璃液封管的管口,所测结果将(填“偏高”、“偏低”或“无影响”)。组卷:6引用:2难度:0.5 -
27.研究NOx之间的转化具有重要意义。
(1)已知:N2O4(g)⇌2NO2(g)ΔH>0
将一定量N2O4气体充入恒容的密闭容器中,控制反应温度为T1。
①下列可以作为反应达到平衡的判据是。
A.气体的压强不变B.v正(N2O4)=2v逆(NO2)C.K不变
D.容器内气体的密度不变E.容器内颜色不变
②t1时刻反应达到平衡,混合气体平衡总压强为p,N2O4气体的平衡转化率为75%,则反应N2O4(g)═2NO2(g)的平衡常数Kp=(对于气相反应,用某组分B的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数,记作Kp,如p(B)=p•x(B),p为平衡总压强,x(B)为平衡系统中B的物质的量分数)。
③反应温度T1时,c(N2O4)随t(时间)变化曲线如图1,画出0~t2时段,c(NO2)随t变化曲线。
保持其它条件不变,改变反应温度为T2(T2>T1),再次画出0~t2时段,c(NO2)随t变化趋势的曲线。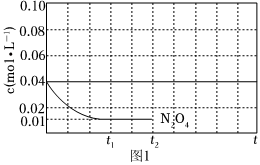
(2)NO氧化反应:2NO(g)+O2(g)═2NO2(g)分两步进行,其反应过程能量变化示意图如图2。
Ⅰ2NO(g)→N2O2(g)ΔH1
ⅡN2O2(g)+O2(g)→2NO2(g)ΔH2
①决定NO氧化反应速率的步骤是(填“Ⅰ”或“Ⅱ”)。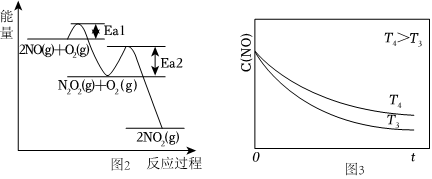
②在恒容的密闭容器中充入一定量的NO和O2气体,保持其它条件不变,控制反应温度分别为T3和T4(T4>T3),测得c(NO)随t(时间)的变化曲线如图3。
转化相同量的NO,在温度(填“T3”或“T4”)下消耗的时间较长,试结合反应过程能量图(图2)分析其原因。组卷:476引用:9难度:0.7


