2022-2023学年江苏省南通市高一(下)期末化学试卷
发布:2024/7/2 8:0:9
一、单项选择题:共13题,每题3分,共39分。每题只有一个选项最符合题意。
-
1.科技发展离不开材料的不断更新和优化。下列有关说法正确的是( )
组卷:22引用:2难度:0.5 -
2.黑火药是中国古代四大发明之一,其㩧炸反应为2KNO3+S+3C═K2S+3CO2↑+N2↑。下列说法正确的是( )
组卷:44引用:1难度:0.5 -
3.实验室制取SO2并探究其性质,下列实验装置能达到实验目的的是( )
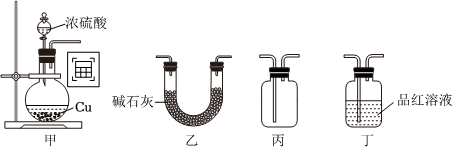 组卷:21引用:1难度:0.5
组卷:21引用:1难度:0.5 -
4.阅读下列材料,回答4~6题:
氮元素可形成多种化合物。肼(H2N-NH2)又称联氨,是一种可燃性的液体,可用作火箭燃料。叠氮酸(HN3)是一种弱酸,可通过亚硝酸氧化肼获得。硝酸是一种易挥发的液体,硝酸和纤维素可发生酯化反应制备硝酸纤维。工业上利用NH3催化氧化生成NO,反应为4NH3+5O24NO+6H2O,将NO进一步氧化,用水吸收制备HNO3。催化剂Δ
下列有关含氮微粒的说法正确的是( )组卷:14引用:0难度:0.70 -
5.阅读下列材料,回答4~6题:
氮元素可形成多种化合物。肼(H2N-NH2)又称联氨,是一种可燃性的液体,可用作火箭燃料。叠氮酸(HN3)是一种弱酸,可通过亚硝酸氧化肼获得。硝酸是一种易挥发的液体,硝酸和纤维素可发生酯化反应制备硝酸纤维。工业上利用NH3催化氧化生成NO,反应为4NH3+5O24NO+6H2O,将NO进一步氧化,用水吸收制备HNO3。催化剂Δ
下列说法正确的是( )组卷:15引用:0难度:0.60
-
16.某锌焙烧矿(含ZnO和少量FeO、Fe2O3、SiO2等)制备铁黄(FeOOH)和ZnSO4⋅7H2O的步骤如图:
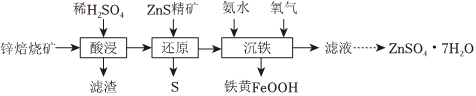
(1)滤渣的主要成分为。
(2)“还原”时加入过量ZnS精矿将Fe3+还原为Fe2+,该反应的化学方程式为。
(3)检验“还原”后的滤液中是否含Fe3+的试剂是。
(4)向“还原”后的滤液中滴加氨水,至pH为5.5时停止滴加,开始通氧气,生成铁黄。通入氧气过程中,溶液pH随时间变化如图-1所示。
已知:25℃时,Fe(OH)2完全沉淀的pH=8.5。
0~t1时段发生的反应为4Fe(OH)2+O2═4FeOOH+2H2O;
t1~t2时段,溶液pH明显降低,请解释原因:。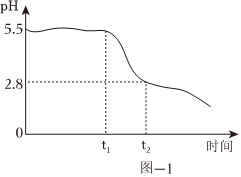
(5)若上述流程中省略“还原”步骤,则制得的FeOOH不纯,可能含有的杂质是。
(6)请补充完整由ZnSO4和Fe2(SO4)3的混合液制备ZnSO4⋅7H2O的实验方案:向混合液中滴加NaOH溶液至pH在3.7~5.7之间,充分反应后过滤;;边搅拌边向滤渣中滴加稀硫酸至沉淀完全溶解;将溶液蒸发浓缩,冷却结晶,过滤,干燥制得ZnSO4⋅7H2O。(实验中须使用的试剂有:NaOH溶液、BaCl2溶液、蒸馏水)。
已知:①当pH>10.5时,Zn(OH)2开始溶解。
②相关离子生成氢氧化物沉淀的pH如下表:离子 开始沉淀的pH 沉淀完全的pH Fe3+ 2.7 3.7 Zn2+ 5.7 9.0 组卷:60引用:1难度:0.5 -
17.含氮化合物对生态环境和人类健康都有一定的影响,必须采取相应的措施来治理或加以控制。
(1)生物硝化反硝化法可将酸性废水中的氨氮转化为氮气,其原理如图-1所示。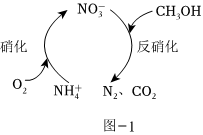
①的空间构型为NO-3。
②每处理含1的酸性废水,理论上消耗CH3OH的物质的量为molNH+4。
③上述生物硝化反硝化法的优点是。
(2)折点加氯法是将次氯酸钠投入废水中,将废水中的氨氮转化为N2的化学脱氮工艺。设定反应温度为25℃,向含的酸性废水中投加NaClO时,NH+4浓度、氯胺(NH2Cl)浓度与投入的NaClO溶液体积的关系如图-2所示。NH+4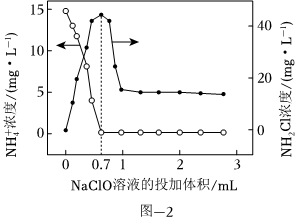
①在酸性废水中,投入的NaClO在0~0.7mL过程中发生的反应为+HClO═NH2Cl+H2O+H+。投入量在0.7∼1.0mL的过程中反应的离子方程式为NH+4。
②实验证明,弱酸性有助于提高废水中氮的脱除率,其原因是。
(3)腌制食品中亚硝酸盐允许残留量(以NaNO2计)≤30mg⋅kg-1。为测定某咸菜中亚硝酸盐的残留量,取0.3kg咸菜榨汁,经处理得无色溶液,将所得溶液转移至250mL容量瓶并定容。取出25mL溶液置于锥形瓶中,加入盐酸调节pH,再滴加KI至过量,待反应完成后用0.0010mol⋅L-1Na2S2O3标准液滴定,共消耗体积为12.00mL。则该市售咸菜的亚硝酸盐残留量是否符合安全标准(写出计算过程)。已知:2+4H++2I-═2NO↑+I2+2H2O;I2+2Na2S2O3═2NaI+Na2S4O6。NO-2组卷:57引用:1难度:0.5


