2022-2023学年福建省厦门市集美中学高二(上)第一次月考化学试卷(10月份)
发布:2024/9/3 2:0:8
一、选择题(每小题只有1个正确答案,每题4分,共48分)
-
 1.利用电解法将CO2转化为CH4的原理如图所示。下列说法正确的是( )组卷:6引用:1难度:0.7
1.利用电解法将CO2转化为CH4的原理如图所示。下列说法正确的是( )组卷:6引用:1难度:0.7 -
2.水煤气是由H2和CO组成的混合气体,在工业上常用作燃料.
已知:2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1
2CO(g)+O2(g)═2CO2(g)△H=-566 kJ•mol-1
现取112L(标准状况)水煤气,使其完全燃烧生成CO2(g)和H2O(l),测得反应放热1423.4kJ,则水煤气中CO与H2的物质的量之比是( )组卷:44引用:4难度:0.8 -
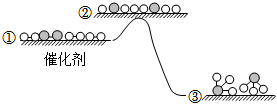 3.H2与N2在催化剂表面生成NH3,反应历程及能量变化示意如图。下列说法错误的是( )组卷:76引用:6难度:0.5
3.H2与N2在催化剂表面生成NH3,反应历程及能量变化示意如图。下列说法错误的是( )组卷:76引用:6难度:0.5 -
4.下列用来表示物质变化的化学用语中,正确的是( )
组卷:199引用:3难度:0.7 -
5.已知:①2H2(g)+O2(g)=2H2O(g)ΔH1;
②2Fe(s)+O2(g)=Fe2O3(s)ΔH2;32
③2Al(s)+O2(g)=Al2O3(s)ΔH3;32
④2Al(s)+Fe2O3(s)=Al2O3(s)+2Fe(s)ΔH4。
下列关于反应焓变的判断正确的是( )组卷:190引用:7难度:0.6
二、填空题
-
16.电解原理在化学工业中有广泛应用。
(1)电解食盐水是氯碱工业的基础。目前比较先进的方法是阳离子交换膜法,电解示意图如图1所示,图中的阳离子交换膜只允许阳离子通过,请回答以下问题:
①电解饱和食盐水的总反应的离子方程式是。
②精制饱和食盐水在b口加入的物质为(写化学式)。
(2)全钒液流电池是一种新型的绿色环保储能系统,工作原理如图2:
①全钒液流电池放电时V2+发生氧化反应,该电池放电时总反应式是离子种类 VO+2VO2+ V3+ V2+ 颜色 黄色 蓝色 绿色 紫色 。
②当完成储能时,阴极溶液的颜色是。
(3)将PbO溶解在HCl和NaCl的混合溶液中,得到含Na2PbCl4的电解液,电解Na2PbCl4溶液生成Pb的装置如图所示。
①写出电解时阴极的电极反应式。
②电解过程中通过阳离子交换膜的离子主要为。
③电解过程中,Na2PbCl4电解液浓度不断减小,为了恢复其浓度,应该向极室(填“阴”或者“阳”)加入(填化学式)。组卷:58引用:5难度:0.5 -
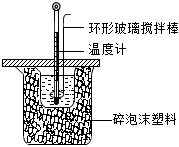 17.利用如图所示装置测定中和热的实验步骤如下:
17.利用如图所示装置测定中和热的实验步骤如下:
①用量筒量取50mL 0.50mol•L-1盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50mL 0.55mol•L-1 NaOH溶液,并用另一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度.回答下列问题:
(1)为什么所用NaOH溶液要稍过量.
(2)倒入NaOH溶液的正确操作是(填序号).
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)使盐酸与NaOH溶液混合均匀的正确操作是(填序号).
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(4)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1L 1mol•L-1的稀盐酸恰好完全反应,其反应热分别为△H1、△H2、△H3,则△H1、△H2、△H3的大小关系为.
(5)假设盐酸和氢氧化钠溶液的密度都是1g•cm-3,又知中和反应后生成溶液的比热容c=4.18J•g-1•℃-1.为了计算中和热,某学生实验记录数据如下:
依据该学生的实验数据计算,该实验测得的中和热△H=实验序号 起始温度t1/℃ 终止温度t2/℃ 盐酸 氢氧化钠溶液 混合溶液 1 20.0 20.1 23.2 2 20.2 20.4 23.4 3 20.5 20.6 23.6 (结果保留一位小数).
(6)(填“能”或“不能”)用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是.组卷:36引用:5难度:0.5


