2021-2022学年黑龙江省哈尔滨九中高二(上)段考化学试卷(10月份)
发布:2024/9/13 1:0:8
一、单项选择题(每题2分,共36分)
-
1.下列能促进水的电离,并使溶液中pH小于7的操作是( )
①加入NaHSO4固体
②投入一小块金属钠
③通CO2
④通NH3
⑤加热煮沸组卷:80引用:3难度:0.7 -
2.下列说法中不正确的是( )
①将BaSO4放入水中不能导电,所以BaSO4是非电解质
②氨溶于水得到的溶液导电性较差,所以氨水是弱电解质
③NaCl溶液能导电是因为在通电条件下,离解为自由移动的离子
④相同温度下的0.01mol⋅L-1和0.1mol⋅L-1CH3COOH溶液中pH的差小于1
⑤强电解质溶液的导电能力一定比弱电解质溶液的导电能力强组卷:4引用:2难度:0.7 -
3.下列关于焓判据和熵判据的说法中,不正确的是( )
组卷:37引用:2难度:0.9 -
4.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
组卷:13引用:3难度:0.6 -
5.下列事实能用勒夏特列原理解释的是( )
组卷:20引用:5难度:0.7 -
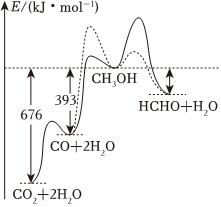 6.研究表明,甲醇通过催化氧化制取甲醛时,在无催化剂(图中实线)和加入特定催化剂(图中虚线)时均会产生甲醛,其反应中物质的相对能量如图所示。下列说法错误的是( )组卷:12引用:2难度:0.6
6.研究表明,甲醇通过催化氧化制取甲醛时,在无催化剂(图中实线)和加入特定催化剂(图中虚线)时均会产生甲醛,其反应中物质的相对能量如图所示。下列说法错误的是( )组卷:12引用:2难度:0.6 -
7.下列说法正确的是( )
组卷:101引用:2难度:0.5 -
8.已知某二元酸H2A在溶液中存在电离:H2A═H++HA-,HA-⇌H++A2-,K=1.2×10-2,设NA为阿伏加德罗常数的值。关于常温下0.001mol⋅L-1的H2A溶液,下列说法正确的是( )
组卷:18引用:2难度:0.7
三、非选择题(4小题,共52分)
-
25.研究氮的氧化物解对环境保护有重要意义。
Ⅰ.(1)已知反应2N2O(g)⇌2N2(g)+O2(g)ΔH=-163kJ⋅mol-1,1molN2(g)、1molO2(g)分子中化学键断裂时分别需要吸收945kJ、498kJ的能量,则2molN2O(g)分子中化学键断裂时需要吸收的能量为kJ。
(2)实验1:在t℃时,无催化剂的恒容容器中,反应2N2O(g)⇌2N2(g)+O2(g)起始压强为p0的部分实验数据如下:
①在0~30min 时段,反应速率v(O2)为反应时间 0 10 20 30 40 50 60 70 80 90 100 c(N2O)/mol/L 0.100 0.090 0.080 0.070 0.060 0.050 0.040 0.030 0.020 0.010 0.010 mol⋅L-1⋅min-1。
②若N2O起始浓度c0为0.250mol⋅L-1,则反应至50min时N2O的转化率α=。比较不同起始浓度时N2O的分解速率:v(c0=0.250mol⋅L-1)v(c0=0.100mol⋅L-1)(填“>”、“=”或“<”)。
③在该温度下,反应的平衡常数 Kp=(用p0表示,列计算式即可)。
④在t℃时,不同催化剂下产生氧气的体积V(O2)与分解时间的关系如图,下列说法正确的是。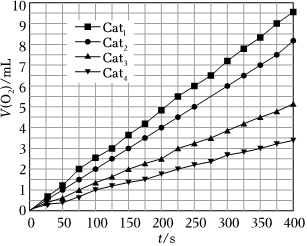
A.其他条件不变时,增大N2O的浓度,提高了单位体积N2O的活化分子数,N2O的分解速率加快
B.保持温度不变,缩小反应容器的体积,N2O分解的速率加快
C.由图可知,Catl催化效率最高
D.其他条件相同时,Catl催化分解N2O的活化能比用Cat4催化分解N2O的活化能小。
⑤不同温度(T)下,N2O分解半衰期随起始压强的变化关系如图所示(图中半衰期指任一浓度N2O消耗一半时所需的相应时间),则T1T2(填“>”、“=”或“<”)。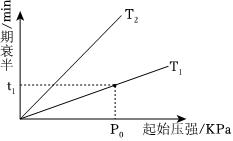
Ⅱ.科学家利用反应对汽车尾气进行无害化处理,发生如下反应:2CO+2NO⇌2CO2+N2。CO的平衡转化率与温度、起始投料比m的关系如图所示,图中起始投料比m=。n(NO)n(CO)
(1)图中m1与m2大小关系是。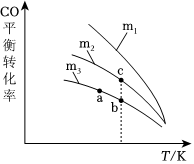
(2)a、b、c三点对应的平衡常数Ka、Kb、Kc相对大小关系是。
(3)随着温度的升高,不同投料比下CO的平衡转化率趋于相近的原因为。组卷:6引用:2难度:0.5 -
26.在K2Cr2O7,溶液中存在下列平衡:Cr2
(aq)+H2O(l)⇌2O2-7(aq)+2H+(aq)K,事实上该过程包含如下两个平衡:CrO2-4
(i)K1=3.00×10-2(25℃)
(ii)(aq)⇌HCrO-4(aq)+H+(aq)K2=3.3×10-7(25℃)CrO2-4
(1)写出(i)平衡离子方程式。
(2)25℃,写出总反应的K=(用含有K1、K2的式子表达)。
(3)下列有关K2Cr2O7溶液的说法正确的是。
A.加入少量硫酸,溶液的橙色加深
B.加入少量水稀释,溶液中离子总数增加
C.加入少量NaOH溶液,反应(i)的平衡逆向移动
D.加入少量K2Cr2O7固体,平衡正向移动,K2Cr2O7转化率变大,平衡时c2()与c(Cr2HCrO-4)的比值变大O2-7
(4)25℃时3.31mol⋅L-1K2Cr2O7溶液中lg随pH的变化关系如图。当pH=9.00时,c(CrO2-4)c(Cr2O2-7)
①设Cr2、O2-7、HCrO-4的平衡浓度分别为x、y、zmol⋅L-1,则x、y、z之间的关系CrO2-4=3.31mol⋅L-1;
②计算溶液中的平衡浓度(结果保留两位有效数字)HCrO-4。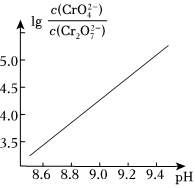 组卷:9引用:2难度:0.4
组卷:9引用:2难度:0.4


