2023-2024学年重庆市璧山区来凤中学高二(上)月考化学试卷(9月份)
发布:2024/9/9 4:0:8
一、选择题(本题共14小题,每小题3分,共42分,在给出的四个选项中,只有一项符合题目要求)
-
1.能源是人类文明发展和进步的基础,化学与能源紧密相关,下列有关说法不正确的是( )
组卷:12引用:3难度:0.8 -
2.已如(NH4)2CO3(s)═NH4HCO3(s)+NH3(g)ΔH=+74.9kJ•mol-1。下列说法中正确的是( )
组卷:13引用:2难度:0.6 -
3.氢气可通过下列反应制得:CO(g)+H2O(g)
CO2(g)+H2(g)△H<0,为了提高氢气在平衡体系中所占的比例,可采取的措施是( )催化剂组卷:23引用:7难度:0.7 -
4.二氧化硫的催化氧化反应:2SO2(g)+O2(g)
2SO3(g)是工业制硫酸的重要反应之一。下列说法错误的是( )催化剂组卷:19引用:1难度:0.7 -
5.下列事实能用勒夏特列原理解释的是( )
组卷:8引用:3难度:0.7 -
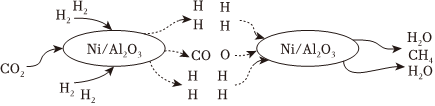 6.我国科研人员提出了以Ni/Al2O3为催化剂,由CO2和H2转化为产品CH4的反应历程,其示意图如图:
6.我国科研人员提出了以Ni/Al2O3为催化剂,由CO2和H2转化为产品CH4的反应历程,其示意图如图:
下列说法不正确的是( )组卷:9引用:1难度:0.8
二、填空题(本题共4小题,共52分)
-
17.根据题意,回答下列问题:
Ⅰ.为实现可持续发展,近年来我国大力加强温室气体CO2催化氢化合成甲醇技术的工业化研究。
(1)已知:CO2(g)+H2(g)═H2O(g)+CO(g)ΔH1=+41.1kJ/mol
CO(g)+2H2(g)═CH3OH(g)ΔH2=-90.0kJ/mol
则CO2催化氢化合成甲醇的热化学方程式:。
Ⅱ.工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g)⇌CH3OH(g)。
(2)判断反应达到平衡状态的依据是(填字母)。
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
(3)如表所列数据是反应在不同温度下的化学平衡常数(K)。
①该反应的化学平衡常数表达式为K=。
②由表中数据判断该反应的ΔH温度℃ 250 300 350 K 2.041 0.270 0.012 0(填“>”、“=”或“<”)。
③某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2mol/L,则此时的温度为℃。
(4)要提高CO的转化率,可以采取的措施是(填字母)。
a.增加CO的浓度
b.加入催化剂
c.升温
d.加入H2
e.加入惰性气体
f.分离出甲醇
Ⅲ.在一定条件下,A(g)+3B(g)⇌C(g)+D(g)ΔH=-49.0kJ/mol,体系中A的平衡转化率(α)与L和X的关系如图所示,L和X分别表示温度或压强。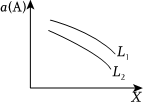
(5)X表示的物理量是。
(6)判断L1与L2的大小关系:L1L2(填“<”“=”或“>”)。组卷:23引用:2难度:0.6 -
18.二甲醚(DME)被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:
①CO(g)+2H2(g)⇌CH3OH(g)△H 1=-90.7 kJ•mol-1 K1
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H 2=-23.5kJ•mol-1 K2
③CO(g)+H2O(g)⇌CO2(g)+H2(g)△H 3=-41.2kJ•mol-1 K3
回答下列问题:
(1)则反应3H2(g)+3CO(g)⇌CH3OCH3(g)+CO2(g)的△H=kJ•mol-1;该反应的平衡常数K=(用K1、K2、K3表示)
(2)下列措施中,能提高(1)中CH3OCH3产率的有。
A.使用过量的CO B.升高温度 C.增大压强
(3)一定温度下,0.2molCO和0.1molH2O通入2L恒容密闭容器中,发生反应③,5分钟时达到化学平衡,平衡后测得H2的体积分数为0.1.则5分钟内v(H2O)=,CO的转化率α(CO)=。
(4)将合成气以=2通入1 L的反应器中,一定条件下发生反应:4H2(g)+2CO(g)⇌CH3OCH3(g)+H2O(g)△H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是n(H2)n(CO)。
A.△H<0 B.P1>P2>P3
C.若在P3和316℃时,起始时n(H2)/n(CO)=3,则平衡时,α(CO)小于50%
(5)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚(DME)。观察图2回答问题。催化剂中约为n(Mn)n(Cu)时最有利于二甲醚的合成。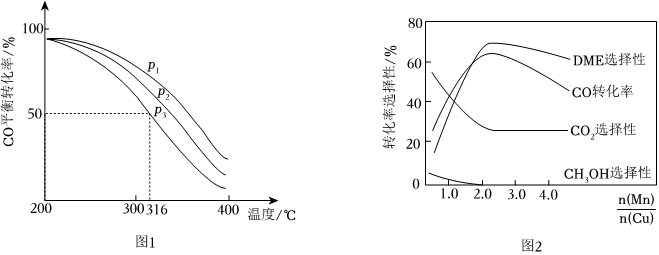 组卷:71引用:13难度:0.5
组卷:71引用:13难度:0.5


