2022-2023学年上海市洋泾中学高二(下)期末化学试卷
发布:2024/8/7 8:0:9
解答题
-
1.随着常规能源的有限性以及环境问题的日益突出,以环保和可再生为特质的新能源越来越得到各国的重视。新能源的使用与研究在一定程度上助力中国实现“碳达峰、碳中和”。
(1)铅酸电池,其结构如图所示,放电时的电池反应:PbO2+Pb+2H2SO4=2PbSO4+2H2O.根据此反应判断下列叙述中正确的是。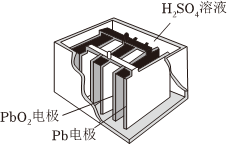
A.PbO2是电池的负极
B.Pb是负极
C.PbO2得电子,被氧化
D.电池放电时,溶液酸性增强
(2)由铜、锌和稀硫酸组成的原电池工作时,电解质溶液的pH值。
A.不变
B.先变小后变大
C.逐渐变小
D.逐渐变大
(3)港珠澳大桥设计寿命120年,对桥体钢构件采用了多种防腐方法。下列分析错误的是。
A.防腐原理主要是避免发生反应:2Fe+O2+2H2O=2Fe(OH)2
B.钢构件表面喷涂环氧树脂涂层,是为了隔绝空气、水等防止形成原电池
C.采用外加电流的阴极保护时需外接镁、锌等活泼金属做阳极
D.钢构件可采用不锈钢材料以减缓电化学腐蚀
(4)用如图装置可以模拟铁的电化学防护,下列说法不正确的是。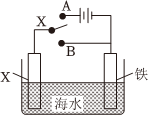
A.若X为锌棒,开关K置于B处时,铁电极反应为2H++2e-=H2↑
B.若X为锌棒,开关K置于A或B处均可减缓铁的腐蚀
C.若X为碳棒,开关K置于A处时,铁电极反应2H2O+2e-=H2↑+2OH-
D.若X为碳棒,开关K置于A处可以减缓铁的腐蚀
(5)如图是乙醇燃料电池工作时的示意图,乙池中M、N两个电极的材料是石墨和铁中的一种,工作时M、N两个电极的质量都不减少,请回答: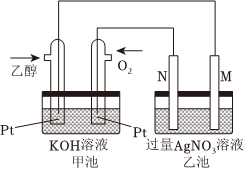
①甲池中通入乙醇的铂电极名称是,通入O2的铂电极反应式为;
②乙池属于(填“原电池”或“电解池”),工作时,乙池中电子流出的电极是(填“M”或“N”);
③若乙池中某电极析出金属银4.32g时,甲池中理论上消耗氧气为L(标准状况下);
④如要用电解方法精炼粗铜,乙池电解液选用CuSO4溶液,则N电极的材料是,反应一段时间以后,CuSO4溶液的浓度。(填“增大”“减小”“不变”)组卷:96引用:1难度:0.6
解答题
-
4.芯片制造过程需用到光刻胶,光刻胶的一种合成路线如图(部分试剂、反应条件和产物已略去):
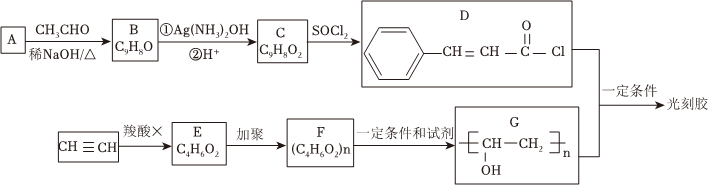
已知:A是苯甲醛(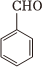
Ⅰ.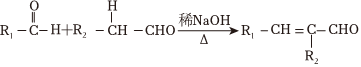 (R1、R2为烃基或氢)
(R1、R2为烃基或氢)
Ⅱ. (R1、R2为烃基)
(R1、R2为烃基)
(1)B分子中所含官能团的名称为;由F到G的反应类型为。
(2)如何配制银氨溶液?。
(3)B转化为C的第①步的化学方程式为。
(4)乙炔和羧酸X发生加成反应生成E,E中不同环境的氢原子个数比为3:2:1,E能发生水解反应,则E加聚后产物F的结构简式为。
(5)D和G反应生成光刻胶的化学方程式为。
(6)C的一种同分异构体满足下列条件:
①既能发生银镜反应,又能发生水解反应;
②苯环上的一氯取代产物只有两种。
写出该同分异构体的结构简式:。
(7)根据已有知识并结合本题信息,写出以CH3CHO为原料制备CH3COCOCOOH的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。组卷:66引用:1难度:0.3
解答题
-
5.水,是一切生命之源,水也是一种弱电解质。
(1)下列物质溶于水时会破坏水的电离平衡,且属于电解质的是。
A.氨气
B.二氧化碳
C.氯化钾
D.醋酸钠
(2)相同温度时100mL0.01mol•L-1的醋酸溶液与10mL0.01mol•L-1的醋酸溶液相比较,下列数值前者大于后者的是。
A.中和时所需NaOH的量
B.电离程度
C.电离平衡常数
D.醋酸的物质的量
(3)已知水在25℃和95℃时,其电离平衡曲线如图所示。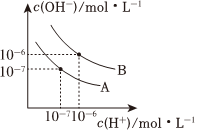
①25℃时水的电离平衡曲线应为(填“A”或“B”),请说明理由。
②95℃时,若100体积pH=a的某强酸溶液与1体积pH=b的某强碱溶液混合后溶液呈中性,则a与b之间应满足的关系是。
(4)下表是25℃时某些弱酸的电离平衡常数。
①pH相同的NaClO和CH3COOK溶液,其溶液的物质的量浓度的大小关系是CH3COOK化学式 CH3COOH HClO H2CO3 H2C2O4 Ka/mol•L-1 Ka=1.8×10-5 Ka=3.0×10-8 Ka1=4.1×10-7
Ka2=5.6×10-11Ka1=5.9×10-2
Ka2=6.4×10-5NaClO(填“>”“<”或“=”,下同),两溶液中:[Na+]-[ClO-][K+]-[CH3COO-]。
②若0.1mol•L-1CH3COOH溶液与0.1mol•L-1NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,则[Na+]-[CH3COO-]=。
③取10mLpH=2的CH3COOH溶液,加入少量无水醋酸钠固体(假设加入固体前后溶液体积保持不变),待固体溶解后,溶液中的比值将[H+][CH3COOH](填“增大”“减小”或“无法确定”)。
④向碳酸钠溶液中滴加少量氯水的离子方程式。
(5)如图是某温度下,将足量的BaSO4固体溶于一定量水中达到溶解平衡后,假定溶液体积不变的情况下,加入Na2CO3使c()增大过程中,溶液中c(Ba2+)和c(CO2-3)的变化曲线。根据图中的数据分析、计算:SO2-4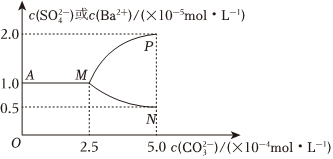
①该温度下,BaSO4的Ksp=。
②当c()大于CO2-3mol•L-1时开始有BaCO3沉淀生成;BaCO3的Ksp=。组卷:71引用:1难度:0.5


