水,是一切生命之源,水也是一种弱电解质。
(1)下列物质溶于水时会破坏水的电离平衡,且属于电解质的是 DD。
A.氨气
B.二氧化碳
C.氯化钾
D.醋酸钠
(2)相同温度时100mL0.01mol•L-1的醋酸溶液与10mL0.01mol•L-1的醋酸溶液相比较,下列数值前者大于后者的是 BB。
A.中和时所需NaOH的量
B.电离程度
C.电离平衡常数
D.醋酸的物质的量
(3)已知水在25℃和95℃时,其电离平衡曲线如图所示。
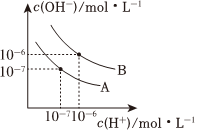
①25℃时水的电离平衡曲线应为 AA(填“A”或“B”),请说明理由 水电离需要吸热,温度越高Kw越大水电离需要吸热,温度越高Kw越大。
②95℃时,若100体积pH=a的某强酸溶液与1体积pH=b的某强碱溶液混合后溶液呈中性,则a与b之间应满足的关系是 a+b=14a+b=14。
(4)下表是25℃时某些弱酸的电离平衡常数。
| 化学式 | CH3COOH | HClO | H2CO3 | H2C2O4 |
| Ka/mol•L-1 | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
Ka1=5.9×10-2 Ka2=6.4×10-5 |
>
>
NaClO(填“>”“<”或“=”,下同),两溶液中:[Na+]-[ClO-]=
=
[K+]-[CH3COO-]。②若0.1mol•L-1CH3COOH溶液与0.1mol•L-1NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,则[Na+]-[CH3COO-]=
9.9×10-7mol•L-1
9.9×10-7mol•L-1
。③取10mLpH=2的CH3COOH溶液,加入少量无水醋酸钠固体(假设加入固体前后溶液体积保持不变),待固体溶解后,溶液中
[
H
+
]
[
C
H
3
COOH
]
减小
减小
(填“增大”“减小”或“无法确定”)。④向碳酸钠溶液中滴加少量氯水的离子方程式
2+Cl2+H2O═Cl-+ClO-+2
CO
2
-
3
HCO
-
3
2+Cl2+H2O═Cl-+ClO-+2
。CO
2
-
3
HCO
-
3
(5)如图是某温度下,将足量的BaSO4固体溶于一定量水中达到溶解平衡后,假定溶液体积不变的情况下,加入Na2CO3使c(
CO
2
-
3
SO
2
-
4
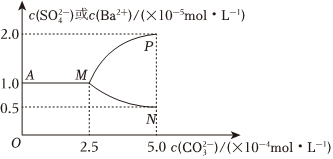
①该温度下,BaSO4的Ksp=
1.0×10-10
1.0×10-10
。②当c(
CO
2
-
3
2.5×10-4
2.5×10-4
mol•L-1时开始有BaCO3沉淀生成;BaCO3的Ksp=2.5×10-9
2.5×10-9
。【答案】D;B;A;水电离需要吸热,温度越高Kw越大;a+b=14;>;=;9.9×10-7mol•L-1;减小;2+Cl2+H2O═Cl-+ClO-+2;1.0×10-10;2.5×10-4;2.5×10-9
CO
2
-
3
HCO
-
3
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/8/6 8:0:9组卷:71引用:1难度:0.5


