2022-2023学年陕西省咸阳市礼泉县高二(上)期中化学试卷
发布:2024/9/22 1:0:8
一、选择题(本大题共16小题,每小题3分,计48分。每小题只有一个选项是符合题意的)
-
1.下列措施有利于实现“碳达峰、碳中和”的是( )
组卷:6引用:2难度:0.8 -
2.中华传统文化蕴含着很多化学科学知识,下列说法错误的是( )
组卷:3引用:2难度:0.8 -
3.利用太阳光在新型复合催化剂表面实现高效分解水,其主要过程如图1所示。下列说法正确的是( )
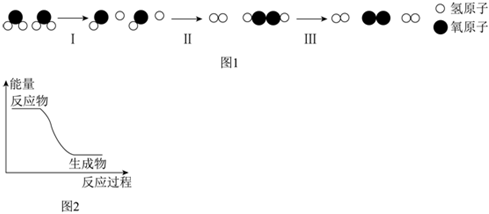 组卷:3引用:2难度:0.7
组卷:3引用:2难度:0.7 -
4.在2A(s)+B(g)⇌3C(g)+4D(g)反应中,表示该反应速率最慢的是( )
组卷:4引用:3难度:0.5 -
5.下列关于反应能量的说法正确的是( )
组卷:4引用:2难度:0.7 -
6.某同学设计如图所示实验,探究反应中的能量变化。下列判断正确的是( )
 组卷:47引用:2难度:0.7
组卷:47引用:2难度:0.7 -
7.下列说法不正确的是( )
组卷:2引用:3难度:0.7
二、非选择题(本大题共5小题,计52分)
-
20.某同学利用铁与硫酸的反应,探究影响反应速率的因素(实验所用铁的质量相等且铁块的形状相同,硫酸均过量),实验设计如表:
回答下列问题:实验编号 硫酸浓度/(mol•L-1) 硫酸体积/mL 铁的状态 温度/K 1 1.00 40 块状 293 2 2.00 40 块状 293 3 2.00 40 粉末 293 4 2.00 40 块状 313
(1)若四组实验均以收集到448mL(标准状况)氢气为标准,则上述实验中还需要测定的数据是。
(2)实验1和2是探究对该反应速率的影响;实验和是探究温度对该反应速率的影响。
(3)根据实验测得的在不同时间t产生氢气体积V的数据,绘制得到图甲,则曲线c对应的实验组别可能是。根据实验数据,该同学发现对于每一组实验,产生氢气的速率υ随时间t变化情况如图乙所示,其中t1~t2速率变化的主要原因是。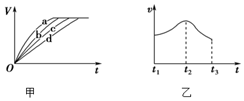
(4)若上述实验所用硫酸体积均为250mL,实验3反应进行2min时收集到448mL(标准状况)氢气,该时间段内以硫酸的浓度变化表示的平均反应速率v(H2SO4)=(反应后溶液体积不变)。
(5)实验4如果反应太激烈,为了减缓反应速率而又不影响产生氢气的量,下列措施你认为可行的是(填编号)。
A.加蒸馏水
B.减小压强
C.加入CH3COONa
D.加CuSO4固体
(6)进行实验3时,若将稀硫酸改为40mL4.0mol•L-1盐酸(其他条件不变),发现放出气泡的速率,盐酸明显比硫酸快。你认为可能的原因是(忽略温度对反应速率的影响)。组卷:15引用:3难度:0.6 -
21.SO2、NOx是空气的主要污染物,有效去除大气中的SO2、NOx可以保护大气环境。回答下列问题:
Ⅰ.二氧化硫在V2O5作用下的催化氧化是工业上生产硫酸的主要反应。
(1)钒催化剂参与反应的能量变化如图1所示,请写出VOSO4(s)和V2O4(s)反应生成V2O5(s)与SO2(g)的热化学方程式:。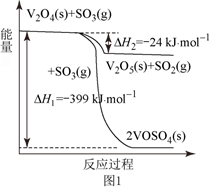
(2)若当SO2、O2、N2(不参与反应)起始的物质的量分数分别为10%、15%和75%时,在压强为0.5MPa、2.5MPa和5.0MPa下,SO2平衡转化率α随温度的变化如图2所示。反应在0.5MPa、550℃时的α=,判断的依据是。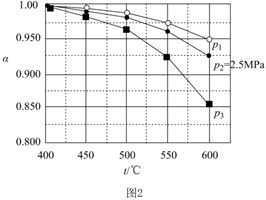
(3)若将物质的量之比为2:1的SO2(g)和O2(g)通入反应器发生反应2SO2(g)+O2(g)⇌2SO3(g),在恒温T、恒压p条件下进行反应。平衡时,若SO2转化率为α,则SO3的分压为,平衡常数Kp=(以分压表示,分压=总压×物质的量分数)。
Ⅱ.一定温度下,在容积恒定为1L的密闭容器中,加入0.30molNO与过量的金属Al,发生的反应存在如下平衡:Al(s)+2NO(g)⇌N2(g)+43Al2O3(s)ΔH<0,已知在此条件下NO与N2的消耗速率与各自的浓度有如下关系:v(NO)=k1⋅c2(NO),v(N2)=k2⋅c(N2),其中k1、k2表示速率常数。23
(4)在T1温度下,k1=0.004L⋅mol-1⋅min-1,k2=0.002L⋅mol-1⋅min-1,则该温度下反应的平衡常数的值为。
(5)在T2温度下,NO的物质的量随时间的变化曲线如图3,则T1T2(填“>”、“=”或“>”)。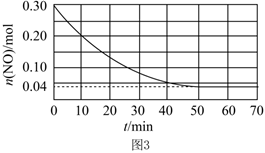 组卷:3引用:2难度:0.5
组卷:3引用:2难度:0.5


