2022-2023学年江苏省常州一中高一(下)期末化学试卷
发布:2024/8/1 8:0:9
一、单选题
-
1.祝融号火星车主体部件采用新型铝基碳化硅材料制造。铝基碳化硅材料属于( )
组卷:57引用:5难度:0.7 -
2.黑火药是中国古代四大发明之一。爆炸反应为2KNO3+3C+S=K2S+3CO2↑+N2↑。下列说法不正确的是( )
组卷:17引用:2难度:0.5 -
3.硫循环在生态系统的诸多领域具有重要意义。在指定条件下,下列选项所示的物质间转化能实现的是( )
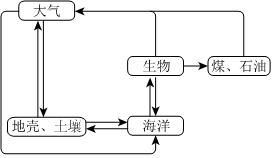 组卷:109引用:3难度:0.8
组卷:109引用:3难度:0.8 -
4.下列说法正确的是( )
组卷:52引用:3难度:0.5 -
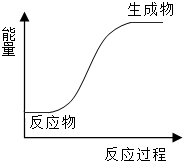 5.下列反应中既是氧化还原反应,能量变化情况又符合如图的是( )组卷:36引用:4难度:0.5
5.下列反应中既是氧化还原反应,能量变化情况又符合如图的是( )组卷:36引用:4难度:0.5 -
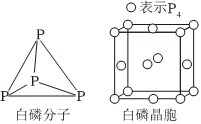 6.氮、磷及其化合物应用广泛,磷元素有白磷、红磷等单质,白磷(P4)分子结构及晶胞如图所示,白磷和红磷转化的热化学方程式为xP4(白磷,s)=4Px(红磷,s)ΔH<0;实验室常用CuSO4溶液吸收有毒气体PH3,生成H3PO4、H2SO4和Cu、P元素可形成多种含氧酸,其中次磷酸(H3PO2)为一元弱酸;磷酸可与铁反应,在金属表面生成致密且难溶于水的磷酸盐膜。下列说法正确的是( )组卷:15引用:2难度:0.8
6.氮、磷及其化合物应用广泛,磷元素有白磷、红磷等单质,白磷(P4)分子结构及晶胞如图所示,白磷和红磷转化的热化学方程式为xP4(白磷,s)=4Px(红磷,s)ΔH<0;实验室常用CuSO4溶液吸收有毒气体PH3,生成H3PO4、H2SO4和Cu、P元素可形成多种含氧酸,其中次磷酸(H3PO2)为一元弱酸;磷酸可与铁反应,在金属表面生成致密且难溶于水的磷酸盐膜。下列说法正确的是( )组卷:15引用:2难度:0.8 -
7.下列化学反应表示正确的是( )
组卷:72引用:1难度:0.6 -
8.下列物质性质与用途具有对应关系的是( )
组卷:22引用:2难度:0.5
二、填空题
-
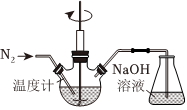 23.利用Zn和KNO3溶液反应模拟地下水的脱硝过程,并探究脱硝原理及相关因素对脱硝速率的影响。模拟过程的实验装置如图所示。
23.利用Zn和KNO3溶液反应模拟地下水的脱硝过程,并探究脱硝原理及相关因素对脱硝速率的影响。模拟过程的实验装置如图所示。
(1)实验室用稀H2SO4洗涤Zn粒,再用蒸馏水洗涤至接近中性;将KNO3溶液的pH调至2.5。
①用稀H2SO4洗涤Zn粒的目的是。
②向上述KNO3溶液中加入足量洗涤后的Zn粒,写出Zn与KNO3溶液反应生成的离子方程式NH+4。
③锥形瓶中NaOH溶液的作用是。
(2)某兴趣小组进行了如下实验:取两套如图所示装置,分别加入等体积、等浓度的KNO3溶液;将溶液的pH值调节为2.5,并通入氮气;将其中一套实验装置浸入热水浴中(或浸入冰水浴中);向三颈瓶中分别加入足量且等质量的同种Zn粒,用离子色谱仪测定相同反应时间时三颈瓶中的浓度。(已知:溶液中的NO-3的物质的量浓度可用离子色谱仪测定)NO-3
①该实验的目的是。
②该实验过程中采用了科学探究中一种重要的思想方法是。
(3)反应过程中有生成。为测定反应液中NO-2的含量,取过滤后的滤液100mL,用0.005mol⋅L-1KMnO4酸性溶液滴定,消耗KMnO4溶液的体积为16.00mL(已知2NO-2+5MnO-4+6H+=2Mn2++5NO-2+3H2O,且在此条件下NO-3不与KMnO4酸性溶液反应)。计算过滤后的滤液中NH+4的物质量浓度NO-2。(写出计算过程)组卷:28引用:2难度:0.6 -
24.为更好地利用化学变化中的物质变化和能量变化,在化学研究和工业生产中还需要关注化学反应的快慢和进行程度等。实验发现,Mg+AgCl滤液反应比Mg+H2O反应速率快,研究小组对此实验现象产生的原因进行了探究。
【提出猜想】
猜想一:Cl-钻入Mg(OH)2膜形成孔径,增大了Mg和H2O的接触面积,加快了Mg+H2O的反应速率,称作“离子钻入效应”;
猜想二:在“离子钻入效应”基础上,Mg置换Ag+形成许多微小的Mg-Ag原电池,使Mg+H2O反应速率进一步加快。
【实验设计】
(1)取表面积和质量相同的镁条(5cm),用浓度分别为1mol/LKCl、0.2mol/LAgNO3、0.2mol/LKNO3溶液,按照下表进行系列实验,若有沉淀,先将沉淀过滤后,将滤液加入装Mg条的试管,并观察Mg条表面实验现象。
①根据表中信息,补充数据:a=实验序号 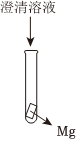
V(KCl)/mL V(AgNO3)/mL V(KNO3)/mL V(H2O)/mL 实验现象 1 / / / 5.00 微小气泡附着 2 4.50 0.50 / / 大量气泡放出 3 4.50 / / 0.50 少量气泡放出 4 a / b / 少量气泡放出 ,b=。
②由实验1和实验3对比可知:Cl-有加快Mg+H2O反应速率的作用。
③由实验和实验对比可知:Ag+有加快Mg+H2O反应速率的作用。
【实验结论1】猜想一和猜想二成立。
写出Ag+的水解离子方程式。
(2)为了进一步证明Mg-Ag原电池能加快Mg+H2O+Cl-体系中Mg+H2O的反应速率,研究小组利用数字化实验进行了验证。
【实验设计】选取实验2和实验4两个实验方案,采集两个实验的pH-时间、温度-时间变化数据。实验数据如图所示: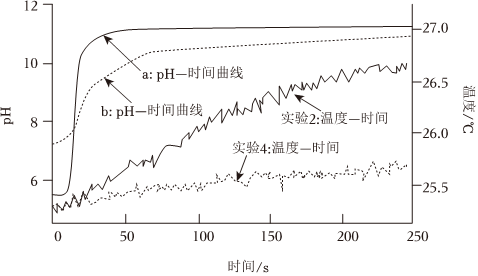
④由初始pH数据可知,曲线(填“a”或“b”)表示实验2的pH-时间变化曲线,请解释原因。
⑤在pH=11左右,两实验的pH变化都明显趋于平缓的原因。
⑥对“温度-时间”曲线分析,在相同反应时间内,(填“实验2”或“实验4”)放热更多,因此速率更快。
【实验结论2】结合pH-时间、温度-时间曲线可知,Mg-Ag原电池能加快Mg+H2O+Cl-体系中Mg+H2O的反应速率。组卷:31引用:2难度:0.7


