为更好地利用化学变化中的物质变化和能量变化,在化学研究和工业生产中还需要关注化学反应的快慢和进行程度等。实验发现,Mg+AgCl滤液反应比Mg+H2O反应速率快,研究小组对此实验现象产生的原因进行了探究。
【提出猜想】
猜想一:Cl-钻入Mg(OH)2膜形成孔径,增大了Mg和H2O的接触面积,加快了Mg+H2O的反应速率,称作“离子钻入效应”;
猜想二:在“离子钻入效应”基础上,Mg置换Ag+形成许多微小的Mg-Ag原电池,使Mg+H2O反应速率进一步加快。
【实验设计】
(1)取表面积和质量相同的镁条(5cm),用浓度分别为1mol/LKCl、0.2mol/LAgNO3、0.2mol/LKNO3溶液,按照下表进行系列实验,若有沉淀,先将沉淀过滤后,将滤液加入装Mg条的试管,并观察Mg条表面实验现象。
| 实验序号 |
|
V(KCl)/mL | V(AgNO3)/mL | V(KNO3)/mL | V(H2O)/mL | 实验现象 |
| 1 | / | / | / | 5.00 | 微小气泡附着 | |
| 2 | 4.50 | 0.50 | / | / | 大量气泡放出 | |
| 3 | 4.50 | / | / | 0.50 | 少量气泡放出 | |
| 4 | a | / | b | / | 少量气泡放出 |
4.5
4.5
,b=0.5
0.5
。②由实验1和实验3对比可知:Cl-有加快Mg+H2O反应速率的作用。
③由实验和实验对比可知:Ag+有加快Mg+H2O反应速率的作用。
【实验结论1】猜想一和猜想二成立。
写出Ag+的水解离子方程式
Ag++H2O⇌AgOH+H+
Ag++H2O⇌AgOH+H+
。(2)为了进一步证明Mg-Ag原电池能加快Mg+H2O+Cl-体系中Mg+H2O的反应速率,研究小组利用数字化实验进行了验证。
【实验设计】选取实验2和实验4两个实验方案,采集两个实验的pH-时间、温度-时间变化数据。实验数据如图所示:
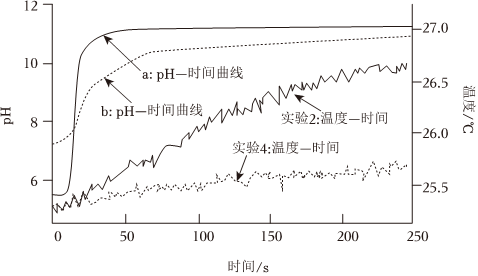
④由初始pH数据可知,曲线
a
a
(填“a”或“b”)表示实验2的pH-时间变化曲线,请解释原因 溶液中存在银离子,银离子水解使得溶液呈酸性,所以初始阶段pH<7
溶液中存在银离子,银离子水解使得溶液呈酸性,所以初始阶段pH<7
。⑤在pH=11左右,两实验的pH变化都明显趋于平缓的原因
Mg(OH)2沉淀覆盖在镁条表面,阻碍了Mg+H2O的反应
Mg(OH)2沉淀覆盖在镁条表面,阻碍了Mg+H2O的反应
。⑥对“温度-时间”曲线分析,在相同反应时间内,
实验2
实验2
(填“实验2”或“实验4”)放热更多,因此速率更快。【实验结论2】结合pH-时间、温度-时间曲线可知,Mg-Ag原电池能加快Mg+H2O+Cl-体系中Mg+H2O的反应速率。
【考点】探究影响化学反应速率的因素.
【答案】4.5;0.5;Ag++H2O⇌AgOH+H+;a;溶液中存在银离子,银离子水解使得溶液呈酸性,所以初始阶段pH<7;Mg(OH)2沉淀覆盖在镁条表面,阻碍了Mg+H2O的反应;实验2
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/8/1 8:0:9组卷:31引用:2难度:0.7
相似题
-
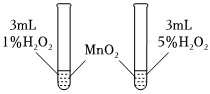 1.控制变量法是化学实验的常用方法之一,如图所示实验探究影响反应速率的因素是( )发布:2024/12/30 14:0:1组卷:44引用:3难度:0.6
1.控制变量法是化学实验的常用方法之一,如图所示实验探究影响反应速率的因素是( )发布:2024/12/30 14:0:1组卷:44引用:3难度:0.6 -
 2.(一)Fenton法常用于处理含有难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.实验中控制p-CP的初始浓度相同,恒定实验温度在298K或313K下设计如下对比实验(其余实验条件见下表):
2.(一)Fenton法常用于处理含有难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.实验中控制p-CP的初始浓度相同,恒定实验温度在298K或313K下设计如下对比实验(其余实验条件见下表):
(1)编号③的实验目的是实验序号 实验目的 T/K pH c/10-3mol•L-1 H2O2 Fe2+ ① 为以下实验作参照物 298 3 6.0 0.30 ② 探究温度对降解反应速率的影响 313 3 6.0 0.30 ③ 298 10 6.0 0.30 .
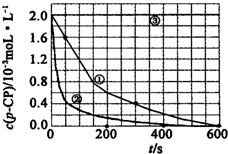
(2)实验测得不同实验编号中p-CP的浓度随时间变化的关系如图所示.请根据实验①曲线,计算降解反应在50-300s内的平均反应速率v(p-CP)=.
(3)实验①②表明,温度与该降解反应速率的关系是.
(二)已知Fe3+和I-在水溶液中的反应为2I-+2Fe3+=2Fe2++I2.正向反应速率和I-、Fe3+的浓度关系为v=kcm(I-)cn(Fe3+)(k为常数)
(4)请分析下表提供的数据回答以下问题:
①在v=kcm(I-)cn(Fe3+)中,m、n的值为c(I-)/(mol•L-1) c(Fe3+)/(mol•L-1) v/(mol•L-1•s-1) (1) 0.20 0.80 0.032k (2) 0.60 0.40 0.144k (3) 0.80 0.20 0.128k .(选填A、B、C、D)
A.m=1,n=1 B.m=1,n=2 C.m=2,n=1 D.m=2,n=2
②I-浓度对反应速率的影响Fe3+浓度对反应速率的影响(填“<”、“>”或“=”).
(三)一定温度下,反应FeO(s)+CO(g)⇌Fe(s)+CO2(g)的化学平衡常数为3.0,该温度下将2mol FeO、4mol CO、5mol Fe、6mol CO2加入容积为2L的密闭容器中反应.请通过计算回答:
(5)v(正)v(逆)(填“>”、“<”或“=”);若将5mol FeO、4mol CO加入同样的容器中,在相同温度下达到平衡,则CO的平衡转化率为.发布:2024/12/30 14:30:1组卷:19引用:2难度:0.5 -
3.为探究影响化学反应速率的因素,某研究小组设计了如下五个实验。按要求回答下列问题(已知:Cu2+、Fe3+对H2O2的分解起催化作用)。
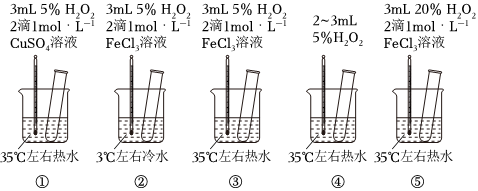
(1)为探究温度对化学反应速率的影响,应选择实验(填序号,下同),选择的依据是。
(2)为探究催化剂对化学反应速率的影响,同时探究催化剂不同催化效果不同,应选择实验。
(3)通过观察发现实验⑤比实验③现象明显,其原因是。
(4)根据上述实验,用H2O2快速制取少量O2,可采取的三条措施为。发布:2024/12/30 14:30:1组卷:8引用:5难度:0.5


