2023年江苏省苏州市振华中学中考化学二模试卷
发布:2024/6/27 8:0:9
一、单项选择题(包括20小题,每题2分,共40分,每题只有一个选项符合题意。)
-
1.推动绿色发展,促进人与自然和谐共生。下列做法中,不符合环境保护要求的是( )
组卷:52引用:7难度:0.6 -
2.如图标志是我国“国家节水标志”的是( )
组卷:31引用:5难度:0.8 -
3.下列人体所缺元素与引起的健康问题关系正确的是( )
组卷:545引用:33难度:0.7 -
4.阅读下列材料,结合所学的化学知识回答4~6题。
21世纪是海洋开发与利用的世纪,海洋化学资源的利用体现了人类利用和改造物质的智慧。海洋蕴含着丰富的油气资源。我国南海中南部油气地质资源量占我国总储量的53%,可采资源量占66%。西沙群岛、中沙群岛的水下有上千米的新生代沉积物,是大有希望的海底石油和天然气产地。海水中存在大量的氯化钠、氯化镁、氯化钙等盐类物质,生活中的食盐主要来自海洋。
海洋中存在的下列物质的化学式书写正确的是( )组卷:28引用:0难度:0.80 -
5.阅读下列材料,结合所学的化学知识回答4~6题。
21世纪是海洋开发与利用的世纪,海洋化学资源的利用体现了人类利用和改造物质的智慧。海洋蕴含着丰富的油气资源。我国南海中南部油气地质资源量占我国总储量的53%,可采资源量占66%。西沙群岛、中沙群岛的水下有上千米的新生代沉积物,是大有希望的海底石油和天然气产地。海水中存在大量的氯化钠、氯化镁、氯化钙等盐类物质,生活中的食盐主要来自海洋。
下列有关利用海水的方法:
①海水“晒盐”;
②海水“制碱”;
③海水淡化;
④从海水中提取镁。
其中主要利用了物理变化的是( )组卷:26引用:0难度:0.80 -
6.阅读下列材料,结合所学的化学知识回答4~6题。
21世纪是海洋开发与利用的世纪,海洋化学资源的利用体现了人类利用和改造物质的智慧。海洋蕴含着丰富的油气资源。我国南海中南部油气地质资源量占我国总储量的53%,可采资源量占66%。西沙群岛、中沙群岛的水下有上千米的新生代沉积物,是大有希望的海底石油和天然气产地。海水中存在大量的氯化钠、氯化镁、氯化钙等盐类物质,生活中的食盐主要来自海洋。
下列对海洋化学资源利用的有关叙述不正确的是( )组卷:22引用:0难度:0.60 -
7.利用阳光和空气直接生产甲醇(CH3OH)的过程包括三个步骤,其中第三步反应的微观示意如图所示。下列说法正确的是( )
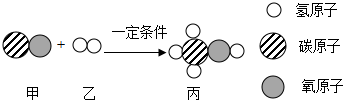 组卷:21引用:2难度:0.6
组卷:21引用:2难度:0.6 -
8.下列说法错误的是( )
组卷:43引用:3难度:0.5
二、非选择题(共60分)
-
25.碳酸钠俗称纯碱或苏打,在生活、生产和实验研究中均有广泛应用。
【制取碳酸钠】工业上以半水煤气(主要成分是N2、H2、CO、CO2和H2O)、食盐等为原料制取纯碱的流程如图1: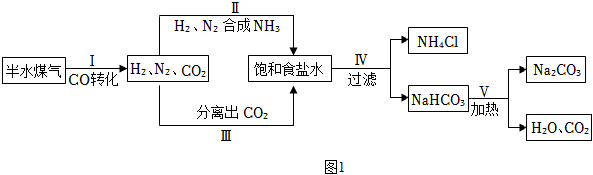
(1)步骤Ⅰ中,在使用铜催化剂和加热条件下,半水煤气主要成分间发生反应实现了CO转化,化学方程式是。
(2)流程中循环利用的物质有H2O和。
(3)实验室从混合气体N2、H2、CO2中分离出CO2的实验装置图2所示。广口瓶和分液漏斗中盛放的药品分别是、。(填溶液名称)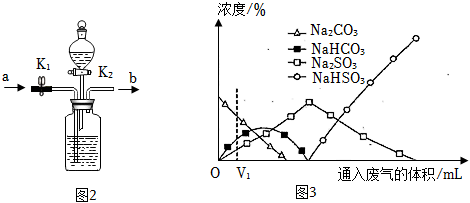
【配制溶液】
(4)若配制50g溶质质量分数为4%的Na2CO3溶液,下列操作正确的是(填字母)。
A.用托盘天平称取2gNa2CO3固体
B.选用100mL量筒量取所需体积的水
C.将配好的溶液装入带玻璃塞的细口试剂瓶中,并贴好标签
D.实验中用到的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管、试剂瓶
【标定浓度】标定待测盐酸的溶质质量分数
(5)将Na2CO3固体在270℃干燥至恒重,准确称取0.212g无水Na2CO3于锥形瓶中,加入50mL蒸馏水溶解,滴入待测盐酸。当两者恰好完全反应时,消耗盐酸的体积为20.00mL(该盐酸的密度近似等于1g•mL-1,反应中Na2CO3所含的碳元素全部转化为CO2)。
①计算待测盐酸的溶质质量分数。(写出计算过程)。
②若上述测定过程中Na2CO3固体未经充分干燥,则测出盐酸的溶质质量分数将(填“偏大”、“偏小”或“无影响”)。
【制备物质】
(6)工业上可用Na2CO3溶液吸收硫酸厂尾气中的SO2制备无水Na2SO3,达到减少污染、节约资源的目的。反应过程中溶液组成变化图3所示。
①吸收初期(图3中通入废气体积V1mL以前)反应的化学方程式为。
②不断通入SO2,最终产物是(填化学式)。组卷:227引用:3难度:0.5 -
26.高铁酸钾(K2FeO4)是一种新型高效多功能绿色净水处理剂,其一种制备方法如图所示:
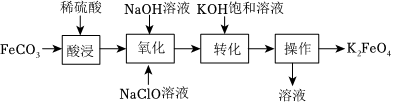
(1)“酸浸”时发生反应的化学方程式为。
(2)“氧化”时FeSO4与NaOH、NaClO反应转化为Na2FeO4。
①Na2FeO4中铁元素的化合价为。
②不同温度和pH下在水溶液中的稳定性如图所示。FeO2-4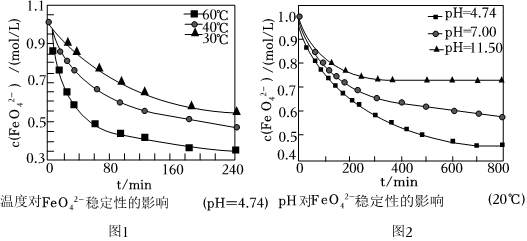
图1、图2中纵坐标表示单位体积内离子数目的多少,数值越小,表明FeO2-4离子数目越少,在该条件下越不稳定。为了提高“合成”时Na2FeO4的产率,控制反应适宜的条件是FeO2-4。该过程中需加入过量NaOH,其目的是。
(3)“转化”时加入饱和KOH溶液,即可析出K2FeO4晶体,写出反应的化学方程式为。
(4)“操作”的名称是;洗涤K2FeO4晶体时,用酒精而不用蒸馏水的优点:①减少晶体溶解损耗;②。
(5)K2FeO4净水时生成的胶状物具有疏松多孔的网状结构,可悬浮于水中的杂质,使之从水中沉降出来。
(6)K2FeO4的纯度与烘干温度的关系如下表,80℃时铁元素的存在形式为(填化学式)。
不同温度所得产品特性:
(7)以23.2kgFeCO3为原料制备K2FeO4,产率为30%,计算所得产品的实际质量(写出计算过程)。干燥温度/℃ 纯度/% 产品颜色 25 92.5 紫红色 60 98.3 紫黑色 80 0 红色 组卷:102引用:1难度:0.5


