2022-2023学年吉林省吉林市高二(上)期中化学试卷
发布:2024/6/7 8:0:9
一、选择题(15道题,每小题只有一个选项符合题目要求,每题3分,共45分)
-
1.化学与生产、生活密切相关。下列说法错误的是( )
组卷:3引用:2难度:0.7 -
2.合成氨工业采用循环操作,主要为了( )
组卷:155引用:10难度:0.9 -
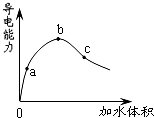 3.在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示.下列说法不正确的是( )组卷:169引用:12难度:0.9
3.在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示.下列说法不正确的是( )组卷:169引用:12难度:0.9 -
4.在密闭容器里,A与B反应生成C,其反应速率分别用vA、vB、vC表示,已知2vB=3vA、3vC=2vB,则此反应可表示为( )
组卷:1090引用:127难度:0.9 -
5.已知强酸与强碱的稀溶液发生中和反应的热化学方程式为H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1,向0.1L 0.2mol•L-1的NaOH溶液中加入下列物质:①稀醋酸;②浓硫酸;③稀盐酸,恰好完全反应。则其焓变△H1、△H2、△H3的关系是( )
组卷:163引用:5难度:0.5 -
6.为了除去MgCl2酸性溶液中的Fe3+,可在加热搅拌的条件下加入一种试剂过滤后,再加入适量的盐酸,这种试剂是( )
组卷:515引用:117难度:0.9
二、非选择题(4道题,共55分)
-
 18.C1化学又称一碳化学,研究以含有一个碳原子的物质为原料合成工业产品的有机化学及工艺,因其在材料科学和开发清洁燃料方面的重要作用已发展成为一门学科。燃煤废气中的CO、CO2均能转化为基础化工原料、清洁能源甲醇。一定条件下,在恒压密闭容器中投入9molCO和15molH2,催化剂作用下充分反应,CH3OH在平衡混合气中的体积分数在不同压强下随温度的变化如图所示:
18.C1化学又称一碳化学,研究以含有一个碳原子的物质为原料合成工业产品的有机化学及工艺,因其在材料科学和开发清洁燃料方面的重要作用已发展成为一门学科。燃煤废气中的CO、CO2均能转化为基础化工原料、清洁能源甲醇。一定条件下,在恒压密闭容器中投入9molCO和15molH2,催化剂作用下充分反应,CH3OH在平衡混合气中的体积分数在不同压强下随温度的变化如图所示:
(1)该反应的平衡常数为K═则化学方程式为c(CH3OH)[c(CO)c2(H2)],该反应的ΔH0,ΔS0(填“>”“=”或“<”)。
(2)P1、P2、P3由大到小的顺序为,计算A点的压强平衡常数Kp═(用平衡分压代替平衡浓度计算,分压=总压×体积分数)。
(3)300℃,P2条件下,处于E点时反应的方向是(填“正反应”“逆反应”或“平衡状态”)。
(4)某温度下,能说明该反应已经达到平衡状态的是(填序号)。
A.容器内各组分浓度相等
B.速率之比v(CO):v(H2):v(CH3OH)=1:2:1
C.H2的消耗速率等于CH3OH的消耗速率
D.容器内混合气体的平均相对分子质量不再变化
E.容器内的密度不再变化组卷:12引用:2难度:0.5 -
19.亚砷酸(H3AsO3)可用于治疗白血病,亚砷酸在溶液中存在多种微粒形态,各种微粒的物质的量分数与溶液pH的关系如图所示。

(1)人体血液的pH为7.35~7.45,用药后人体所含砷元素的主要微粒是。
(2)将KOH溶液逐滴滴入H3AsO3溶液中,当pH由11变化到12过程中,所发生反应的离子方程式是。
(3)H3AsO3第一步电离的方程式为,电离常数为Ka1,则pKa1=(pKa1=-lgKa1);已知碳酸的电离常数Ka1=4.5×10-7、Ka2=4.7×10-11,将少量K2CO3溶液加入H3AsO3溶液中,写出反应的离子方程式。
(4)下列说法中正确的是(填序号)。
A.pH=12时,c(H2)+2c(AsO-3)+3c(HAsO2-3)+c(OH-)=c(H+)AsO3-3
B.pH=14时,c()>c(AsO3-3)>c(H2HAsO2-3)>c(OH-)AsO-3
C.Na2HAsO3溶液中,c()>c(H2HAsO2-3)>c(AsO-3)AsO3-3
(5)工业含砷(Ⅲ)废水常用铁盐处理后排放。其原理是:铁盐混凝剂在溶液中产生Fe(OH)3胶粒,其表面带有正电荷,可吸附含砷化合物。通过实验测得不同pH条件下铁盐对含砷(Ⅲ)化合物的去除率,如图所示pH为5~9时,随溶液pH的增大,铁盐混凝剂对含砷(Ⅲ)化合物的吸附效果增强。结合本题图示,解释可能的原因。【注】砷(Ⅲ)代表化合价为+3价的砷元素。
①;
②。组卷:3引用:2难度:0.5


