2022-2023学年北京市西城区高一(下)期末化学试卷
发布:2024/8/3 8:0:9
一、本部分共25题,每题2分,共50分。在每题列出的四个选项中,选出最符合题目要求的一项。
-
1.下列建筑材料的主要成分不属于无机非金属材料的是( )
组卷:41引用:5难度:0.7 -
2.下列过程属于人工固氮的是( )
组卷:97引用:3难度:0.8 -
3.常温下,下列物质可用铁质容器盛装的是( )
组卷:140引用:2难度:0.7 -
4.下列金属中,通常用加热分解法冶炼的是( )
组卷:30引用:1难度:0.8 -
5.下列反应属于吸热反应的是( )
组卷:42引用:3难度:0.7 -
6.下列过程属于物理变化的是( )
组卷:90引用:26难度:0.9 -
7.下列关于甲烷的说法不正确的是( )
组卷:223引用:3难度:0.6 -
8.下列物质的用途不正确的是( )
组卷:14引用:4难度:0.7 -
9.下列模型表示的分子中,不可能由碳和氢两种元素的原子构成的是( )
组卷:21引用:1难度:0.8 -
10.糖类、油脂、蛋白质是重要的营养物质。下列说法不正确的是( )
组卷:93引用:2难度:0.6 -
11.下列做法与调控化学反应速率无关的是( )
组卷:49引用:1难度:0.5
二、本部分共8题,共50分。
-
32.化学小组同学用铜与过量浓硝酸反应制备NO2气体,实验后发现溶液呈绿色,对其原因进行如下探究。
(1)甲同学提出猜想:浓硝酸中溶解了生成的NO2呈黄色,黄色与蓝色叠加显绿色。
实验:向2mL6mol/LHNO3中通入稳定的NO2气流,溶液变黄。取该溶液与蓝色Cu(NO3)2溶液混合,观察到溶液显绿色,验证了猜想。
甲同学进一步探究硝酸溶液中何种粒子与NO2作用显黄色。
①写出铜和浓硝酸反应产生NO2的化学方程式实验装置 操作 编号 溶液a 现象 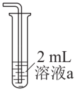
向溶液a中通入稳定的NO2气流8s 实验1 溶液基本无色 实验2 3mol/LH2SO4溶液 立即变黄 实验3 3mol/LNa2SO4溶液 溶液基本无色 。
②实验1中溶液a是。
③依据上述实验推知,浓硝酸中溶解NO2呈黄色是溶液中与NO2作用的结果。
(2)资料:i.铜与浓硝酸反应过程中可生成HNO2,HNO2易分解产生无色气体。
ii.HNO2是一种弱酸。
HNO2电离出,NO-2与Cu2+发生如下反应:Cu2++4NO-2[Cu(NO2)4]2-(绿色)NO-2
乙同学依据资料提出猜想:铜与浓硝酸反应过程中生成[Cu(NO2)4]2-,使溶液呈绿色。
实验4:2mLNaNO2溶液与2mLCu(NO3)2溶液混合,溶液呈绿色,加入1mL浓硝酸后,溶液变蓝。
丙同学对加入浓硝酸后溶液变蓝的原因提出猜想并进行实验验证。
猜想1:加入浓硝酸后发生反应:+H+═HNO2,NO-2浓度下降,绿色消失。猜想2:酸性条件下HNO2分解,NO-2浓度下降,绿色消失。NO-2
①补全HNO2分解的化学方程式:将实验4中蓝色溶液分成两份 加入2mLNaOH溶液,振荡 溶液变绿色 加入2mLH2O,振荡 溶液仍为蓝色 HNO2═NO++。
②用离子方程式表示加入NaOH溶液的作用。
③丙同学依据实验推知猜想(填“1”或“2”)成立。
(3)综合上述实验得出:过量浓硝酸与铜反应后溶液呈绿色的主要原因是。组卷:60引用:3难度:0.5 -
33.钢铁行业酸洗工艺产生的废液主要含有FeCl2和HCl。以空气和钢铁酸洗废液为原料可以合成Fe2(OH)nCl6-n。工业上常加入NaNO2,以提高反应速率。
(1)向酸洗废液中加入少量NaNO2,并通入空气。前期发生的反应:
Ⅰ.HCl+NaNO2═HNO2+NaCl
Ⅱ.HCl+HNO2+FeCl2═FeCl3+NO+H2O
后期转化过程如图: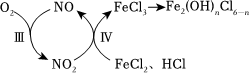
已知:
i.催化剂加快反应的一种方式是自身参与反应最终又生成,自身的质量和化学性质并不发生改变
ii.室温下可发生反应Fe2++NO═[Fe(NO)]2+,[Fe(NO)]2+受热可再分解为Fe2+和NO
①反应Ⅳ的化学方程式是。
②下列说法正确的是(填字母)。
a.由反应Ⅱ可以判断此条件下HNO2的氧化性强于Fe3+
b.加入NaNO2的主要目的是得到NO,作为后期反应的催化剂
c.后期转化过程的总反应可表示为4FeCl2+O2+(4-2n)HCl2Fe2(OH)nCl6-n+(2-2n)H2O催化剂
③反应过程中需控制温度在80℃左右。温度不能太低的原因是(写出两点)。
(2)为了测定产品的质量,用以下方法测定产品中铁元素的质量分数:取ag产品,加入一定量的硫酸,充分反应后加入蒸馏水稀释,得到100mL待测液。取20mL待测液,加入足量KI溶液,充分反应后再与cmol/LNa2S2O3溶液反应,恰好消耗vmLNa2S2O3溶液。
已知:
i.Na2S2O3与I2的反应为:I2+2S2═2I-+S4O2-3O2-6
ii.溶液酸性较强时Na2S2O3不稳定,可发生反应:Na2S2O3+H2SO4═Na2SO4+SO2↑+S↓+H2O
①加入硫酸不能过多,主要原因有两点:
a.硫酸过多时,溶液中c(H+)浓度过大,会加快O2将I-氧化为I2,从而造成误差。写出O2氧化I-的离子方程式。
b.。
②产品中铁元素的质量分数为。组卷:40引用:4难度:0.5


