2023年北京市海淀区高考化学查漏补缺试卷
发布:2024/7/11 8:0:9
一、化学实验:
-
1.下列实验过程中观察到的现象与氧化还原反应有关的是( )
组卷:56引用:1难度:0.7 -
2.将浓氨水分别滴加到下列试剂中,产生的实验现象、体现出的NH3•H2O性质以及对应的方程式不正确的是( )
实验 试剂 现象 性质 方程式 A 滴有酚酞的蒸馏水 溶液变红 碱性 NH3•H2O═ +OH-NH+4B 氯气 产生白烟 还原性 3Cl+8NH3•H2O═N2+6NH4Cl+8H2O C 烧碱固体 产生刺激性气味的气体 不稳定性 NH3•H2O NH3↑+H2O△D CuSO4溶液 溶液最终变为深蓝色 可形成配合物 Cu2++4NH3•H2O═[Cu(NH3)4]2++4H2O 组卷:187引用:4难度:0.7 -
3.为除去某NaCl样品中少量的
,取适量该NaCl样品溶解后,依次进行如图操作:SO2-4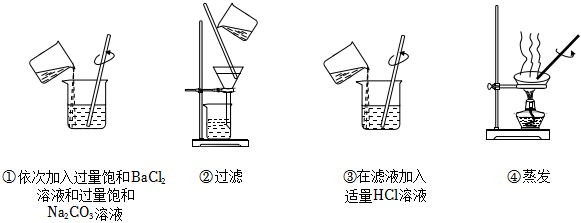
已知:Ksp(BaSO4)=1.1×10-10 Ksp(BaCO3)=5.1×10-9
取少量提纯后的NaCl固体,加水溶解,向溶液中滴加BaCl2溶液,仍能看到白色浑浊。为提高的去除率,下列改进操作有效的是( )SO2-4组卷:77引用:3难度:0.7 -
4.某实验小组探究过量甲醛与新制氢氧化铜的反应。
提出猜想:HCHO+Cu(OH)2Cu+CO↑+2H2O△
已知:ⅰ.CO+2Ag(NH3)2OH═2Ag↓+(NH4)2CO3+2NH3
ⅱ.Cu2O+H2SO4═Cu+CuSO4+H2O
下列说法不正确的是( )实验步骤 实验装置及内容 实验现象 步骤1 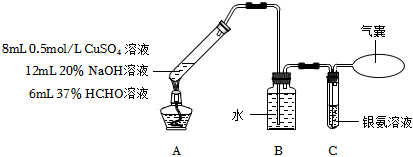
反应结束后,A中生成红色固体,C无明显变化 步骤2 将A中混合物过滤,洗涤所得固体,取少量固体于试管中,加入稀硫酸,振荡 无明显现象 步骤3 取步骤2中的滤液于试管中,加入足量稀盐酸 无明显现象 组卷:94引用:6难度:0.4 -
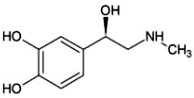 5.肾上腺素具有提高心脏收缩力、扩张气管的功能,其结构如图所示。配制肾上腺素注射剂时要加抗氧化剂、遮光密封置阴凉处存放。下列有关肾上腺素说法不正确的是( )组卷:67引用:4难度:0.5
5.肾上腺素具有提高心脏收缩力、扩张气管的功能,其结构如图所示。配制肾上腺素注射剂时要加抗氧化剂、遮光密封置阴凉处存放。下列有关肾上腺素说法不正确的是( )组卷:67引用:4难度:0.5
第二部分
-
16.某小组同学用银氨溶液制备银镜,并探究反应后银镜的处理方法。
Ⅰ.银镜的制备
(1)配制银氨溶液时,随着氨水滴加到硝酸银溶液中,观察到先产生棕黄色沉淀,然后沉淀消失,形成无色透明的溶液。该过程中发生的反应有:
a.AgNO3+NH3•H2O═AgOH↓+NH4NO3
b.AgOH+2NH3•H2O═Ag(NH3)2OH+2H2O
c.2AgOH(白色沉淀)═Ag2O(棕黑色沉淀)+H2O
d.(补全d的反应)。
(2)写出乙醛与银氨溶液反应的化学方程式。
(3)该小组探究银镜反应的最佳条件,部分实验数据如表:
①推测当银氨溶液的量为1mL,乙醛的量为3滴,水浴温度为60℃,出现银镜的时间范围是实验序号 银氨溶液/mL 乙醛/滴 水浴温度/℃ 出现银镜时间/min 1 1 3 65 5 2 1 5 65 t 3 1 3 50 6 。
②推测实验2中的t5min(填“大于”、“小于”或“等于”)。
Ⅱ.银镜的处理
(4)取一支附有银镜的试管,加入2mL稀硝酸,银镜较快溶解,有气泡产生,该反应的离子方程式为。
(5)在两支含等量银镜的试管中分别加入2mL1mol•L-1FeCl3和Fe(NO3)3溶液,充分振荡,两支试管中均发生不同程度的溶解,前者银镜溶解的量明显多于后者,且前者有灰色沉淀生成。结合化学用语解释FeCl3和Fe(NO3)3溶液溶解银镜效果好的原因。
(6)取一支含银镜的试管,加入5mL10%H2O2溶液,振荡,发生剧烈反应,产生大量气泡,银镜在气泡的影响下呈颗粒状逐渐脱离试管内壁,并沉积在试管底部。结合实验现象,小组同学认为Ag催化H2O2分解,该过程分为两步:
ⅰ.2Ag+H2O2═Ag2O+H2O;
ⅱ.(补全ⅱ的反应)。
(7)反思:根据上述过程,清洗银镜可选择的试剂是,此试剂的优点是。组卷:23引用:1难度:0.5 -
17.某小组同学探究铜和浓硝酸的反应,进行如下实验:
实验1:分别取3mL浓硝酸与不同质量的铜粉充分反应,铜粉完全溶解,溶液颜色如表:
(1)写出铜和浓硝酸反应的离子反应方程式:编号 ① ② ③ ④ ⑤ 铜粉质量/g 0.1 0.2 0.3 0.4 0.5 溶液颜色 绿色 草绿色 蓝绿色偏绿 蓝绿色偏蓝 蓝色 。
(2)小组同学认为溶液呈绿色的可能原因是:
猜想1:硝酸铜浓度较高,溶液呈绿色;
猜想2:NO2溶解在硝酸铜溶液中,溶液呈绿色。
依据实验1中的现象,判断猜想1是否合理,并说明理由:。
(3)取⑤中溶液,(填操作和现象),证实猜想2成立。
(4)小组同学进行如下实验也证实了猜想2成立。
实验2:向①中溶液以相同流速分别通入N2和空气,观察现象。
结合上述实验现象,下列推测合理的是通入气体 氮气 空气 现象 液面上方出现明显的红棕色气体,25min后溶液变为蓝色 液面上方出现明显的红棕色气体,5min后溶液变为蓝色 (填字母序号)。
a.①中溶液通入N2时,N2被缓慢氧化为NO2
b.①中溶液里某还原性微粒与绿色有关,通入空气时较快被氧化
c.空气中的CO2溶于水显酸性,促进了溶液变蓝色
d.加热溶液①后,可能观察到溶液变蓝的现象
(5)小组同学继续探究实验2中现象的差异,并查阅文献知:
ⅰ.“可溶性铜盐中溶解亚硝酸 (HNO2)”可能是实验①中溶液显绿色的主要原因
ⅱ.NO2在溶液中存在:
反应1:2NO2+H2O⇌HNO3+HNO2(慢)
反应2:2HNO2⇌NO2+NO+H2O(快)
解释实验2中“通入氮气变蓝慢,通入空气变蓝快”的原因。
(6)小组同学为确认亚硝酸参与了形成绿色溶液的过程,继续进行实验。
实验3:取3份等体积的①中绿色溶液,分别加入不同物质,观察现象。
实验中加入的固体物质是加入物质 固体 3滴30%H2O2溶液 3滴水 现象 溶液绿色变深 溶液迅速变为蓝色 溶液颜色几乎不变 (填化学式),加入H2O2后溶液迅速变蓝可能的原因是(用化学方程式表示):H2O2+2NO2═2HNO3,,。组卷:86引用:7难度:0.5


