当前位置:
章节挑题
请展开查看知识点列表
>
更多>>
 已完结
已完结
|
热点预测
中考复习
热搜题专练
浏览次数:198
更新:2025年04月27日
|
 已完结
已完结
|
热点预测
高考复习
新题抢练
浏览次数:290
更新:2025年04月25日
|
691.可以用阴离子交换膜控制电解液中OH-的浓度来制备纳米Cu2O,总反应为2Cu+H2O
Cu2O+H2↑,装置如图所示,下列说法正确的是( )电解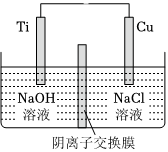 发布:2024/5/23 20:38:36组卷:23引用:3难度:0.5
发布:2024/5/23 20:38:36组卷:23引用:3难度:0.5692.如图所示3套实验装置,分别回答下列问题。

(1)装置1为铁的吸氧腐蚀实验。一段时间后,向插入铁钉的玻璃筒内滴入K3[Fe(CN)6]溶液,即可观察到铁钉附近的溶液变蓝色沉淀,表明铁被(填“氧化”或“还原”);向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应为。
(2)装置2中的石墨是极(填“正”或“负”),该装置发生的总反应的离子方程式为。
(3)装置3中甲烧杯盛放100mL 0.2mol/L的NaCl溶液,乙烧杯盛放100mL 0.5mol/L的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红。
①电源的M端为极;甲烧杯中铁电极的电极反应为。
②乙烧杯中电解反应的离子方程式为。
③停止电解,取出Cu电极,洗涤、干燥、称量、电极增重 0.64g,甲烧杯中产生的气体标准状况下体积为mL。发布:2024/5/23 20:38:36组卷:96引用:4难度:0.5693.水溶液呈酸性的是( )
发布:2024/5/23 20:38:36组卷:237引用:5难度:0.5694.等物质的量浓度的下列五种溶液:①CH3COOH ②(NH4)2CO3 ③NaHSO4 ④NaHCO3 ⑤Ba(OH)2,溶液中水的电离程度由大到小排列正确的是( )
发布:2024/5/23 20:38:36组卷:59引用:9难度:0.7695.聚合硫酸铁[Fe2(OH)6-2n(SO4)n]m广泛用于水的净化。以FeSO4•7H2O为原料,经溶解、氧化、水解聚合等步骤,可制备聚合硫酸铁。
(1)将一定量的FeSO4•7H2O溶于稀硫酸,在约70℃下边搅拌边缓慢加入一定量的H2O2溶液,继续反应一段时间,得到红棕色粘稠液体。H2O2氧化Fe2+的离子方程式为;水解聚合反应会导致溶液的pH。
(2)测定聚合硫酸铁样品中铁的质量分数:准确称取液态样品3.000g,置于250mL锥形瓶中,加入适量稀盐酸,加热,滴加稍过量的SnCl2溶液(Sn2+将Fe3+还原为Fe2+),充分反应后,除去过量的Sn2+.用5.000×10-2mol•L-1 K2Cr2O7溶液滴定至终点(滴定过程中Cr2O72-与Fe2+反应生成Cr3+和Fe3+),消耗K2Cr2O7溶液22.00mL。
①上述实验中若不除去过量的Sn2+,样品中铁的质量分数的测定结果将(填“偏大”或“偏小”或“无影响”)。
②计算该样品中铁的质量分数(写出计算过程)。发布:2024/5/23 20:38:36组卷:542引用:4难度:0.5696.K2Cr2O7溶液中存在平衡:Cr2
(橙色)+H2O⇌2O2-7(黄色)+2H+。用K2Cr2O7溶液进行下列实验:结合实验,下列说法不正确的是( )CrO2-4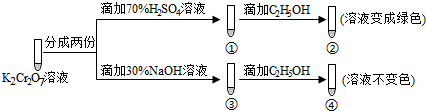 发布:2024/5/23 20:38:36组卷:22引用:3难度:0.6
发布:2024/5/23 20:38:36组卷:22引用:3难度:0.6697.已知
(1)H2( g )+O2 ( g )=H2O ( g )△H1=a kJ/mol12
(2)2H2( g )+O2 ( g )=2H2O ( g )△H2=b kJ/mol
(3)H2( g )+O2 ( g )=H2O ( l )△H3=c kJ/mol12
(4)2H2( g )+O2 ( g )=2H2O ( l )△H4=d kJ/mol
则a、b、c、d的关系正确的是( )发布:2024/5/23 20:38:36组卷:200引用:7难度:0.5698.一定温度下,一定体积的密闭容器中有如下平衡:H2(g)+I2(g)⇌2HI(g),已知H2和I2的起始浓度均为0.1mol•L-1时,达平衡时HI浓度为0.16mol•L-1.若H2和I2的起始浓度均变为0.2mol•L-1,则平衡时H2的浓度(mol•L-1)是( )
发布:2024/5/23 20:38:36组卷:43引用:5难度:0.9699.下列叙述中正确的是( )
发布:2024/5/23 20:38:36组卷:33引用:5难度:0.7700.已知化学反应 S(1)+O2(g)═SO2(g),通常情况下,燃烧1moLS液体生成SO2气体放出 293.23kJ 的热量。分析下列说法中正确的是( )
发布:2024/5/23 20:38:36组卷:62引用:4难度:0.7



