当前位置:
章节挑题
请展开查看知识点列表
>
更多>>
 已完结
已完结
|
热点预测
中考复习
热搜题专练
浏览次数:57
更新:2025年04月27日
|
 已完结
已完结
|
热点预测
高考复习
新题抢练
浏览次数:242
更新:2025年04月25日
|
861.处于平衡状态的反应2H2S(g)⇌2H2(g)+S2(g)△H>0,不改变其他条件的情况下合理的说法是( )
发布:2024/4/20 14:35:0组卷:81引用:16难度:0.9862.已知反应mA(g)+nB(g)⇌pC(g)ΔH<0,m+n<p,当反应达到平衡后,有关物质的浓度发生改变,其反应速率的变化曲线分别如图所示:

回答下列问题:
(1)表示反应物浓度增大的图象是(填序号,下同),表示反应物浓度减小的图象是,表示生成物浓度增大的图象是,表示生成物浓度减小的图象是。
(2)表示平衡正向移动的图象是,表示平衡逆向移动的图象是。发布:2024/4/20 14:35:0组卷:6引用:2难度:0.5863.碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质。请回答下列问题:
(1)有机物M经过太阳光光照可转化成N,转化过程如图: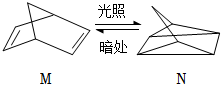 ΔH=+88.6kJ•mol-1则M、N相比,较稳定的是 。(用字母“M”或“N”表示)
ΔH=+88.6kJ•mol-1则M、N相比,较稳定的是 。(用字母“M”或“N”表示)
(2)已知CH3OH(l)的燃烧热ΔH=-238.6kJ/mol,CH3OH(l)+O2(g)═CO2(g)+2H2(g)ΔH=-a kJ/mol,则a12-238.6(填“>”、“<”或“=”)。
(3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1molCl2参与反应时释放出145kJ热量,写出该反应的热化学方程式:。
(4)火箭和导弹表面的薄层是耐高温物质.将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s)═2Al2O3(s)+3TiC(s)ΔH=-1176kJ/mol,则反应过程中,还原产物是,每转移1mol电子放出的热量为kJ。
(5)盖斯定律在生产和科学领域有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)ΔH=-24.8kJ/mol
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)ΔH=-47.2kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)ΔH=+640.4kJ/mol
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:。发布:2024/4/20 14:35:0组卷:20引用:3难度:0.5864.化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
发布:2024/4/20 14:35:0组卷:319引用:6难度:0.4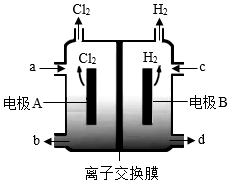 865.在氯碱工业中,离子交换膜法电解饱和食盐水示意图如图,下列说法不正确的是( )发布:2024/4/20 14:35:0组卷:16引用:3难度:0.7
865.在氯碱工业中,离子交换膜法电解饱和食盐水示意图如图,下列说法不正确的是( )发布:2024/4/20 14:35:0组卷:16引用:3难度:0.7866.下列溶液的酸碱性及对应的解释均正确的是( )
选项 溶液 酸碱性 解释 A Fe2(SO4)3溶液 酸性 Fe3++3H2O⇌Fe(OH)3↓+3H+ B Na2S溶液 碱性 S2-+2H2O⇌H2S+2OH- C KHSO3溶液 酸性 HSO3-+H2O⇌H2SO3+OH- D NaHCO3溶液 碱性 HCO3-+H2O⇌H2CO3+OH- 发布:2024/4/20 14:35:0组卷:21引用:4难度:0.8867.某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:
(1)通过实验A、B,可探究出实验序号 实验
温度/K有关物质 溶液颜色褪至无色所需时间/s 酸性KMnO4溶液 H2C2O4溶液 H2O V/mL c/mol•L-1 V/mL c/mol•L-1 V/mL A 293 2 0.02 4 0.1 0 t1 B T1 2 0.02 3 0.1 V1 8 C 313 2 0.02 V2 0.1 1 t2 (填外部因素)的改变对化学反应速率的影响,其中V1=、T1=;通过实验(填实验序号)可探究出温度变化对化学反应速率的影响,其中V2=。
(2)若t1<8,则由此实验可以得出的结论是;忽略溶液体积的变化,利用实验B中数据计算,0~8s内,用KMnO4的浓度变化表示的反应速率v(KMnO4)=。
(3)该小组的一位同学通过查阅资料发现,上述实验过程中n(Mn2+)随时间的变化情况如图所示,并认为造成这种变化的原因是反应体系中的某种粒子对KMnO4与草酸之间的反应有某种特殊作用,则该作用是,相应的粒子最可能是(填粒子符号)。 发布:2024/4/20 14:35:0组卷:22引用:5难度:0.5
发布:2024/4/20 14:35:0组卷:22引用:5难度:0.5868.臭氧是理想的烟气脱硝试剂,其脱硝反应为2NO2(g)+O3(g)⇌N2O5(g)+O2(g),若反应在
恒容密闭容器中进行,下列由该反应相关图象作出的判断正确的是( )A B C D 



升高温度,平衡常数减少 0~3s内,反应速率为:v(NO2)=0.2mol•L-1•s-1 t1时仅加入催化剂,平衡正向移动 达平衡时,仅改变x,则x为c(O2) 发布:2024/4/20 14:35:0组卷:68引用:12难度:0.6869.在一个固定体积的密闭容器中,加入2molA和1molB发生反应:2A(g)+B(g)⇌3C(g)+D(g)达到平衡时,C的浓度为n mol•L-1。若维持容器的体积和温度不变,按下列各种配比为起始物质,达到平衡后,C的浓度仍为n mol•L-1的是( )
发布:2024/4/20 14:35:0组卷:178引用:2难度:0.7870.利用CH4可消除NO2的污染,反应原理为:CH4(g)+2NO2(g)⇌N2(g)+CO2(g)+2H2O(g),在10L密闭容器中分别加入0.50mol CH4和1.2molNO2,测得不同温度下n(CH4)随时间变化的有关实验数据如表所示:下列说法正确的是( )
组别 温度/K 时间/min
物质的量/mol0 10 20 40 50 1 T1 n(CH4) 0.50 0.35 0.25 0.10 0.10 2 T2 N(CH4) 0.50 0.30 0.18 M 0.15 发布:2024/4/20 14:35:0组卷:49引用:9难度:0.7



