当前位置:
章节挑题
请展开查看知识点列表
>
更多>>
 已完结
已完结
|
热点预测
中考复习
热搜题专练
浏览次数:40
更新:2025年04月27日
|
 已完结
已完结
|
热点预测
高考复习
新题抢练
浏览次数:233
更新:2025年04月25日
|
891.下列表述中正确的是( )
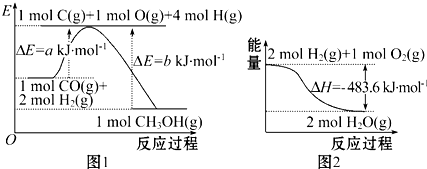 发布:2024/4/20 14:35:0组卷:24引用:3难度:0.8
发布:2024/4/20 14:35:0组卷:24引用:3难度:0.8892.钙、铅均是重要的金属元素,在工农业生产中有着广泛的应用.
(1)加热条件下用 CO 还原 PbO 可得到单质铅.已知:
①2Pb(s)+O2(g)═2PbO(s)△H=-438KJ/mol
②2CO(g)+O2(g)═2CO2(g)△H=-566KJ/mol
则 CO 还原 PbO 的热化学方程式为.
(2)与 CaSO4•2H2O 脱水反应相关的热化学方程式有:
CaSO4•2H2O(s)═CaSO4•H2O(s)+12H2O(g)△H1=83.2KJ•mol-l32
CaSO4•2H2O(s)═CaSO4 (s)+2H2O(1)△H2=26KJ•mol-l
CaSO4•H2O(s)═CaSO4 (s)+12H2O(g)△H3=30.8KJ•mol-l12
则该条件下反应H2O(g)═H2O(1)△H=KJ•mol-l.
(3)在 2 000℃时,已知热化学方程式
①CaO(s)+C(s)⇌Ca(g)+CO(g)△H1=aKJ•mol-1
②Ca(g)+2C(g)⇌CaC2(s)△H2=bKJ•mol-1
③2CaO(s)+CaC2(s)⇌3Ca(g)+2CO(g)△H3=aKJ•mol-1
则△H3=KJ•mol-1(用含a、b的代数式表示).
(4)目前工业上合成电石主要采用无焰氧化加热法.
已知:CaO(s)+3C(s)⇌CaC2(g)+CO(g)△H=+464.1KJ•mol-1
C (S)+O2(g)═CO(g)△H=-110.5•mol-1若不考虑热量耗散,原料转化率均为100%,最终炉中出来的气体只有CO.则为了维持热平衡,每生产1 mol CaC2,投料的量为1molCaO、12molC及mol O2.发布:2024/4/20 14:35:0组卷:66引用:3难度:0.1893.依据图象,下列有关说法正确的是( )
 发布:2024/4/20 14:35:0组卷:13引用:3难度:0.6
发布:2024/4/20 14:35:0组卷:13引用:3难度:0.6894.电子工业中,常用氯化铁溶液作为印刷电路铜板蚀刻液。
(1)若向氯化铁溶液中加入一定量的氨水,调节溶液pH,可得红褐色沉淀,该反应的离子方程式为:,该过程中调节溶液的pH为5,则c(Fe3+)为:mol/L。(已知:Ksp[Fe(OH)3]=4.0×10-38)
(2)某探究小组设计如图线路处理废液和资源回收:
①用足量FeCl3溶液蚀刻铜板后的废液中含有的金属阳离子有:。
②步骤①中加入H2O2溶液的目的是:。
(3)已知:生成氢氧化物沉淀的pH
根据表中数据推测调节pH的范围是:Cu(OH)2 Fe(OH)2 Fe(OH)3 开始沉淀时 4.7 7.0 1.9 沉淀完全时 6.7 9.0 3.2 。
写出步骤③中的离子方程式:
(4)已知:Ksp(FeS)=6.5×10-18,Ksp(CuS)=1.3×10-36。向浓度均为0.1 mol•L-1的FeSO4和CuSO4的混合溶液中滴加Na2S溶液,当加入Na2S溶液至出现两种沉淀,溶液中c(Fe2+):c(Cu2+)=。发布:2024/4/20 14:35:0组卷:32引用:1难度:0.6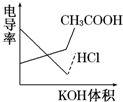 895.电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点。如图是用KOH溶液分别滴定HCl溶液和CH3COOH溶液的滴定曲线示意图。
895.电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点。如图是用KOH溶液分别滴定HCl溶液和CH3COOH溶液的滴定曲线示意图。
下列示意图中,能正确表示用NH3•H2O溶液滴定HCl和CH3COOH混合溶液的滴定曲线的是( )发布:2024/4/20 14:35:0组卷:218引用:12难度:0.7896.水系钠离子电池有成本低、寿命长、环保等诸多优势,未来有望代替锂离子电池和铅酸电池。一种水系钠离子电池放电和充电的工作原理示意图如图所示。下列说法正确的是( )
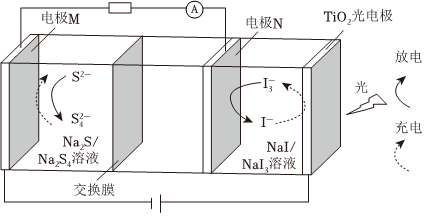 发布:2024/4/20 14:35:0组卷:40引用:6难度:0.6
发布:2024/4/20 14:35:0组卷:40引用:6难度:0.6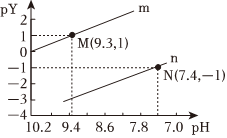 897.常温下向一定浓度的Na2X溶液中滴入盐酸,粒子浓度与混合溶液的pH变化的关系如图所示,已知:H2X是二元弱酸,Y表示或x(X2-)c(HX-),pY=-lgY.下列叙述错误的是( )c(HX-)c(H2X)发布:2024/4/20 14:35:0组卷:175引用:7难度:0.5
897.常温下向一定浓度的Na2X溶液中滴入盐酸,粒子浓度与混合溶液的pH变化的关系如图所示,已知:H2X是二元弱酸,Y表示或x(X2-)c(HX-),pY=-lgY.下列叙述错误的是( )c(HX-)c(H2X)发布:2024/4/20 14:35:0组卷:175引用:7难度:0.5 898.在恒压、NO和O2的起始浓度一定的条件下,催化反应相同时间,测得不同温度下NO转化为NO2的转化率如图中实线所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。下列说法正确的是( )发布:2024/4/20 14:35:0组卷:43引用:24难度:0.5
898.在恒压、NO和O2的起始浓度一定的条件下,催化反应相同时间,测得不同温度下NO转化为NO2的转化率如图中实线所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。下列说法正确的是( )发布:2024/4/20 14:35:0组卷:43引用:24难度:0.5899.现有a mol/L NaX和b mol/L NaY两种盐溶液.下列说法正确的是( )
发布:2024/4/20 14:35:0组卷:21引用:9难度:0.7900.“碘钟”实验中,3I-+S2O82-═I3-+2SO42-的反应速率可以用I3-与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大.某探究性学习小组在20℃下进行实验,得到 的数据如下表:
回答下列问题:实验编号 ① ② ③ ④ ⑤ c(I-)/mol•L-1 0.040 0.080 0.080 0.160 0.120 c(S2O82-)/mol•L-1 0.040 0.040 0.080 0.020 0.040 t/s 88.0 44.0 22.0 44.0 t1
(1)该实验的目的是.
(2)显色时间t1=.
(3)温度对该反应的反应速率的影响符合一般规律,若在40℃下进行编号③对应浓度的实验,显色时间t2的范围为(填字母).
A.<22.0s B.22.0~44.0sC.>44.0s D.数据不足,无法判断
(4)通过分析比较上表数据,得到的结论是.发布:2024/4/20 14:35:0组卷:46引用:6难度:0.3



