2022-2023学年上海市南洋模范中学高一(下)期末化学试卷
发布:2024/8/10 1:0:2
解化学反应热效应
-
1.(1)某化学反应中,反应物的总能量为E1,生成物的总能量为E2,且E1<E2,则该反应是
反应。(选填“A:放热”或“B:吸热”)
(2)下列过程中不一定属于放热过程的是。
A.形成化学键
B.燃料燃烧
C.化合反应
D.酸碱中和
E.炸药爆炸
(3)已知石墨转化为金刚石时需要吸收能量,则两者较稳定的是。(选填“A:石墨”或“B:金刚石”)
(4)等质量的固体硫和硫蒸气完全燃烧,放出热量校多的是(选填“A:固体硫”或“B:硫蒸气”)。
(5)①已知H2与N2反应放热,相关物质键焓见下表。下列关系一定正确的是。
A.E1+E2>4E3化学键 H-H N≡N N-H 键焓/kJ⋅mol-1 E1 E2 E3
B.3E1+E2>6E3
C.3E1+E2<6E3
D.3E1+E2<3E3
②在图中画出25℃时化合生成1molNH3(g)的能量变化。
(6)25℃、100kPa时,充分燃烧一定量的甲烷气体生成CO2和液态水时,放出的热量为QkJ。经测定,将生成的CO2加入足量澄清石灰水中生成25g白色沉淀,写出表示甲烷燃烧热的热化学方程式。
(7)已知:
2C(石墨)+2H2(g)+O2(g)=CH3COOH(l)ΔH=物质 CH3COOH(1) C(石墨) H2(g) 标准燃烧焓/kJ⋅mol-1 -870.3 -393.5 -285.8 kJ⋅mol-1。
(8)将100mL0.5mol⋅L-1盐酸与100mL0.55mol⋅L-1NaOH溶液在量热计中进行中和反应(可将稀酸、稀碱的密度近似与水的密度相等,生成溶液的比热容C=4.18J⋅g-1⋅℃-1)。若温度计示数从25.0℃升到28.4℃,则中和反应的反应热ΔH=kJ⋅mol-1。若分多次将NaOH溶液倒入内筒中,则测得中和热ΔH的绝对值将(选填“A:偏大”或“B:偏小”或“C:不变”,下同);若配制NaOH溶液时俯视容量瓶的刻度线,则测得中和热ΔH的绝对值将。组卷:84引用:1难度:0.7
铁及其化化合物
-
4.铁的化合物有广泛用途,如碳酸亚铁(FeCO3)可作补血剂,铁红(Fe2O3)可作为颜料。利用某硫酸厂产生的烧渣(主要含Fe2O3、FeO,还有一定量的SiO2)制备碳酸亚铁的流程如图所示:
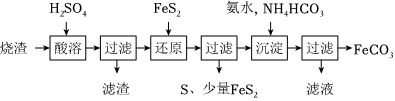
(1)“酸溶”时加入的硫酸不宜过是太多,其原因是:。
(2)检验第1次过滤后的滤液中是否含有Fe2+需要的试剂是。过滤操作需要用到的玻璃仪器有:烧杯、和。
(3)“还原”时,加入的FeS2与Fe3+发生2种氧化还原反应:
①14Fe3++FeS2+8H2O=15Fe2++2+16H+。SO2-4
②。(用离子方程式表示)
(4)“沉淀”时需控制pH值不宜过高,否则生成的FeCO3中可能混有杂质(写出一种即可)。写出“沉淀”时发生反应的离子方程式。
(5)FeCO3浊液若未及时过滤,长时间暴露在空气中会有部分固体表面变为红褐色,同时释放CO2,则与FeCO3反应的物质是(磌化学式)。
(6)FeCO3在空气中煅烧时生成Fe2O3和FeO的混合物。充分煅烧34.8gFeCO3,得到固体混合物23.76g,则混合物中Fe2O3的质量为。组卷:49引用:1难度:0.6
电化学
-
5.某实验小组同学利用如下装置对电化学原理进行了一系列探究活动。
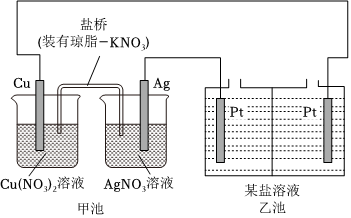
(1)甲池装置为(选填“A:原电池”或“B:电解池”)。
(2)甲池反应前两电极质量相等,工作一段时间后,两电极质量相差14g,则导线中通过mol电子。实验过程中,甲池左侧烧杯中的浓度NO-3(选填“A:增大”或“B:减小”或“C:不变”)。
(3)若乙池中为AgNO3溶液,则乙池发生的总反应方程式为。工作一段时间后,若要使乙池中溶液恢复原浓度,可向溶液中加入(填化学式)。
(4)若乙池中为NaCl溶液,在一定条件下该装置可制备ClO2。已知ClO2易溶于水,可与NaOH发生反应。产生ClO2的电极反应方程式为。乙池中的交换膜是交换膜(选填“A:阴离子”或“B:阳离子”)。
(5)乙池也可用于保护金属或合金不被腐蚀,此时生铁和电极相连(选填“A:Cu”或“B:Ag”),这一方法的名称是。
(6)若将乙池改为精炼铜装置(粗铜含Al、Zn、Ag、Pt、Au等杂质),电解质溶液为CuSO4溶液,则下列说法中正确的是。
A.电解过程中,阳极减少的质量与阴极增加的质量相等
B.乙池左侧电极为粗铜,发生氧化反应
C.CuSO4溶液的浓度保持不变
D.杂质中Ag、Pt、Au以单质的形式沉淀到池底组卷:73引用:1难度:0.6


