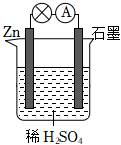
某实验小组同学利用如下装置对电化学原理进行了一系列探究活动。
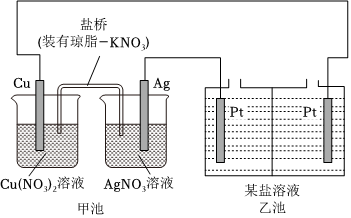
(1)甲池装置为 AA(选填“A:原电池”或“B:电解池”)。
(2)甲池反应前两电极质量相等,工作一段时间后,两电极质量相差14g,则导线中通过 0.10.1mol电子。实验过程中,甲池左侧烧杯中NO-3的浓度 AA(选填“A:增大”或“B:减小”或“C:不变”)。
(3)若乙池中为AgNO3溶液,则乙池发生的总反应方程式为 4AgNO3+2H2O 电解 4HNO3+4Ag↓+O2↑4AgNO3+2H2O 电解 4HNO3+4Ag↓+O2↑。工作一段时间后,若要使乙池中溶液恢复原浓度,可向溶液中加入 Ag2O(或Ag2CO3)Ag2O(或Ag2CO3)(填化学式)。
(4)若乙池中为NaCl溶液,在一定条件下该装置可制备ClO2。已知ClO2易溶于水,可与NaOH发生反应。产生ClO2的电极反应方程式为 Cl--5e-+H2O=ClO2↑+4H+Cl--5e-+H2O=ClO2↑+4H+。乙池中的交换膜是 BB交换膜(选填“A:阴离子”或“B:阳离子”)。
(5)乙池也可用于保护金属或合金不被腐蚀,此时生铁和 AA电极相连(选填“A:Cu”或“B:Ag”),这一方法的名称是 外加电流法外加电流法。
(6)若将乙池改为精炼铜装置(粗铜含Al、Zn、Ag、Pt、Au等杂质),电解质溶液为CuSO4溶液,则下列说法中正确的是 BDBD。
A.电解过程中,阳极减少的质量与阴极增加的质量相等
B.乙池左侧电极为粗铜,发生氧化反应
C.CuSO4溶液的浓度保持不变
D.杂质中Ag、Pt、Au以单质的形式沉淀到池底
N
O
-
3
电解
电解
【考点】原电池与电解池的综合.
【答案】A;0.1;A;4AgNO3+2H2O 4HNO3+4Ag↓+O2↑;Ag2O(或Ag2CO3);Cl--5e-+H2O=ClO2↑+4H+;B;A;外加电流法;BD
电解
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/7/24 8:0:9组卷:73引用:1难度:0.6