(1)某化学反应中,反应物的总能量为E1,生成物的总能量为E2,且E1<E2,则该反应是 BB反应。(选填“A:放热”或“B:吸热”)
(2)下列过程中不一定属于放热过程的是 CC。
A.形成化学键
B.燃料燃烧
C.化合反应
D.酸碱中和
E.炸药爆炸
(3)已知石墨转化为金刚石时需要吸收能量,则两者较稳定的是 AA。(选填“A:石墨”或“B:金刚石”)
(4)等质量的固体硫和硫蒸气完全燃烧,放出热量校多的是 BB(选填“A:固体硫”或“B:硫蒸气”)。
(5)①已知H2与N2反应放热,相关物质键焓见下表。下列关系一定正确的是 CC。
| 化学键 | H-H | N≡N | N-H |
| 键焓/kJ⋅mol-1 | E1 | E2 | E3 |
B.3E1+E2>6E3
C.3E1+E2<6E3
D.3E1+E2<3E3
②在图中画出25℃时化合生成1molNH3(g)的能量变化
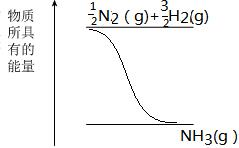

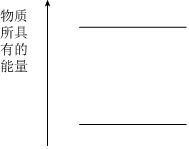
(6)25℃、100kPa时,充分燃烧一定量的甲烷气体生成CO2和液态水时,放出的热量为QkJ。经测定,将生成的CO2加入足量澄清石灰水中生成25g白色沉淀,写出表示甲烷燃烧热的热化学方程式
CH4(g)+2O2(g)=CO2(g)+2H2O(l)ΔH=-4QkJ•mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l)ΔH=-4QkJ•mol-1
。(7)已知:
| 物质 | CH3COOH(1) | C(石墨) | H2(g) |
| 标准燃烧焓/kJ⋅mol-1 | -870.3 | -393.5 | -285.8 |
-488.3
-488.3
kJ⋅mol-1。(8)将100mL0.5mol⋅L-1盐酸与100mL0.55mol⋅L-1NaOH溶液在量热计中进行中和反应(可将稀酸、稀碱的密度近似与水的密度相等,生成溶液的比热容C=4.18J⋅g-1⋅℃-1)。若温度计示数从25.0℃升到28.4℃,则中和反应的反应热ΔH=
-56.848
-56.848
kJ⋅mol-1。若分多次将NaOH溶液倒入内筒中,则测得中和热ΔH的绝对值将 B
B
(选填“A:偏大”或“B:偏小”或“C:不变”,下同);若配制NaOH溶液时俯视容量瓶的刻度线,则测得中和热ΔH的绝对值将 C
C
。【答案】B;C;A;B;C; ;CH4(g)+2O2(g)=CO2(g)+2H2O(l)ΔH=-4QkJ•mol-1;-488.3;-56.848;B;C
;CH4(g)+2O2(g)=CO2(g)+2H2O(l)ΔH=-4QkJ•mol-1;-488.3;-56.848;B;C
 ;CH4(g)+2O2(g)=CO2(g)+2H2O(l)ΔH=-4QkJ•mol-1;-488.3;-56.848;B;C
;CH4(g)+2O2(g)=CO2(g)+2H2O(l)ΔH=-4QkJ•mol-1;-488.3;-56.848;B;C【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/8/9 8:0:9组卷:84引用:1难度:0.7



