2023-2024学年上海交大附中高二(上)开学化学试卷
发布:2024/9/9 0:0:8
-
1.硫是重要的非金属元素,也是人类较早认识的化学元素之一。自然界中的硫元素主要以单质硫、硫化物和硫酸盐等形式存在。
(1)下列物质中的硫元素不能表现出氧化性的是(单选)。
A.Na2S
B.S
C.SO2
D.H2SO4
(2)下列有关浓硫酸的说法中,不正确的是(单选)。
A.浓硫酸能与锌粒反应制备氢气
B.浓硫酸能与灼热的木炭反应,产生二氧化碳和二氧化硫气体
C.浓硫酸具有吸水性,在实验中常用作干燥剂
D.冷的浓硫酸可以用铁质或铝质容器储存
将4g铁粉与2.5g硫粉在研钵中充分混合后装入试管中,在试管口塞上带长导管的橡皮塞,并在导管末端放入一小团蘸有NaOH溶液的棉花,加热试管。
(3)写出铁与硫反应的化学方程式。
(4)已知硫的熔点为106.8℃,沸点为444.7℃,解释试管口为什么向上倾斜。
(5)棉花中的NaOH用于吸收反应过程中产生的二氧化硫,写出该反应的离子方程式。
(6)工业上通常用接触法制硫酸。在制硫酸的生产中,若有32吨硫黄最终全部转化为硫酸,则可以制得质量分数为98%的浓硫酸为吨。已知98%的硫酸密度为1.84g/cm3,计算此溶液的物质的量浓度为mol/L。
氮循环是大气中的氮气经微生物等作用进入土壤与海洋,为动植物所利用,最终又在微生物的参与下返回大气,如此反复循环,建立起的平衡。
(7)土壤中的硝酸盐会被细菌分解。有一种脱氧硫杆菌能够利用土壤中的硫化物来分解硝酸盐,其主要化学原理如下:K2S+KNO3+H2O═N2↑+K2SO4+KOH。配平上述反应方程式,并标出电子转移的方向和数目。
(8)氨态氮(NH3)与亚硝态氮可以在氨氧化细菌的作用下转化为氮气。该反应中,当产生0.02mol氮气时,转移电子的物质的量为(NO-2)mol。组卷:29引用:1难度:0.7
-
4.亚氯酸钠是一种高效氧化剂、漂白剂,主要用于棉纺、亚麻、纸浆漂白以及食品消毒、水处理、杀菌灭藻和鱼药制造。某校化学实验探究小组设计如图实验,用ClO2为原料制备亚氯酸钠(NaClO2)。
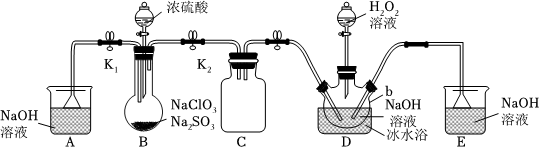
已知:
①2NaClO3+Na2SO3+H2SO4═2ClO2↑+2Na2SO4+H2O
②饱和NaClO2溶液中析出的晶体成分与温度的关系如表所示:
③ClO2极易溶于水,不与水反应,沸点11℃。温度/℃ <38 38~60 >60 晶体成分 NaClO2•3H2O NaClO2 NaClO2分解成NaClO3和NaCl
(1)漂白剂有多种类型,从漂白原理来看,与亚氯酸钠均属于同类型的漂白剂有(单选)。
A.SO2、HClO
B.活性炭、H2O2
C.漂白粉、SO2
D.HClO、H2O2
(2)B中使用浓硫酸而不用稀硫酸的原因是。
(3)B中发生的反应,氧化剂与还原剂物质的量之比为。
(4)装置D中生成NaClO2的离子方程式为。
(5)装置D溶液采用结晶法提取NaClO2晶体,控制温度为℃(填写范围)减压蒸发结晶,趁热过滤,50℃左右热水洗涤,低于60℃条件下干燥,得到成品。如果干燥温度过高可能导致产品中混有的杂质是。
测定样品中NaClO2的纯度。测定时进行如下实验:准确称取所得NaClO2样品mg于小烧杯中,加入适量蒸馏水和过量的碘化钾晶体,在酸性条件下发生充分反应:,将所得混合液稀释成100mL待测溶液。移取25.00mL待测溶液于锥形瓶中,加几滴淀粉溶液,用cmol•L-1的Na2S2O3标准溶液滴定至终点,重复3次,测得消耗Na2S2O3标准溶液的体积平均值为VmL。(已知:I2+2S2ClO-2+4I-+4H+=2H2O+2I2+Cl═2I-+S4O2-3)O2-6
(6)滴定终点的现象是。
(7)该样品中NaClO2质量分数为(用含c、V、m的代数式表示)。组卷:13引用:1难度:0.6
-
5.水是一种很好的溶剂,也是物质发生化学反应的主要介质。水中世界千千万,它与我们的生活、生产密切相关,请用所学知识,解决下列问题。
(1)某温度下纯水中的[H+]=2×10-7mol/L,则此时溶液中的[OH-]=;在该温度下,0.04mol/L的NaOH溶液的pH=;
(2)该温度下,某溶液中由水电离产生的[OH-]和[H+]的乘积为1.6×10-17,则该溶液的pH=。
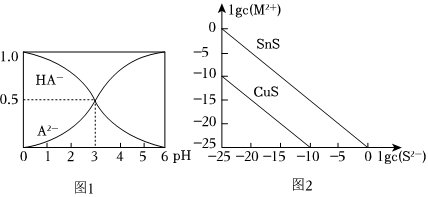
室温下,在1mol/L的某二元酸H2A溶液中,含A元素组分的物质的量分数随pH变化的关系如图1所示:
(3)写出H2A的电离方程式。
(4)根据图象可知室温下HA-的电离平衡常数的数值Ka=。
(5)等物质的量浓度NaHA和Na2A溶液等体积混合,比较混合后的溶液中[Na+]、[HA-]、[A2-]的大小。
已知298K时,CH3COOH的Ka=1.8×10-5、Ka(HNO2)=5.6×10-4。
(6)向0.1mol/L的CH3COONa溶液中逐滴滴加HNO2溶液,当溶液中[HNO2]=[]时,溶液的pH=NO-2(保留2位小数);此时溶液中为[CH3COOH][CH3COO-](取整数)。
25℃时,用Na2S沉淀Cu2+、Sn2+两种金属离子(M2+),所需S2-最低浓度的对数值1gc(S2-)与lgc(M2+)的关系如图2所示,请回答:
(7)25℃时Ksp(CuS)=。
(8)25℃时向50mL的Sn2+、Cu2+浓度均为0.01mol/L的混合溶液中逐滴加入Na2S溶液,当Na2S溶液加到150mL时开始生成SnS沉淀,则此时溶液中Cu2+浓度为mol/L。组卷:60引用:1难度:0.5


