水是一种很好的溶剂,也是物质发生化学反应的主要介质。水中世界千千万,它与我们的生活、生产密切相关,请用所学知识,解决下列问题。
(1)某温度下纯水中的[H+]=2×10-7mol/L,则此时溶液中的[OH-]=2×10-7mol/L2×10-7mol/L;在该温度下,0.04mol/L的NaOH溶液的pH=1212;
(2)该温度下,某溶液中由水电离产生的[OH-]和[H+]的乘积为1.6×10-17,则该溶液的pH=5或95或9。
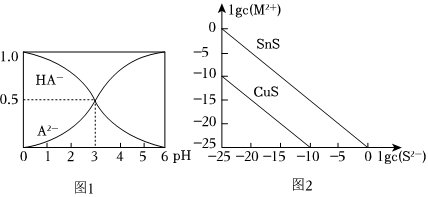
室温下,在1mol/L的某二元酸H2A溶液中,含A元素组分的物质的量分数随pH变化的关系如图1所示:
(3)写出H2A的电离方程式 H2A=HA-+H+、HA-⇌A2-+H+H2A=HA-+H+、HA-⇌A2-+H+。
(4)根据图象可知室温下HA-的电离平衡常数的数值Ka=10-310-3。
(5)等物质的量浓度NaHA和Na2A溶液等体积混合,比较混合后的溶液中[Na+]、[HA-]、[A2-]的大小 [Na+]>[A2-]>[HA-][Na+]>[A2-]>[HA-]。
已知298K时,CH3COOH的Ka=1.8×10-5、Ka(HNO2)=5.6×10-4。
(6)向0.1mol/L的CH3COONa溶液中逐滴滴加HNO2溶液,当溶液中[HNO2]=[NO-2]时,溶液的pH=3.253.25(保留2位小数);此时溶液中[CH3COOH][CH3COO-]为 3131(取整数)。
25℃时,用Na2S沉淀Cu2+、Sn2+两种金属离子(M2+),所需S2-最低浓度的对数值1gc(S2-)与lgc(M2+)的关系如图2所示,请回答:
(7)25℃时Ksp(CuS)=10-3510-35。
(8)25℃时向50mL的Sn2+、Cu2+浓度均为0.01mol/L的混合溶液中逐滴加入Na2S溶液,当Na2S溶液加到150mL时开始生成SnS沉淀,则此时溶液中Cu2+浓度为 2.5×10-132.5×10-13mol/L。
NO
-
2
[
CH
3
COOH
]
[
CH
3
COO
-
]
【答案】2×10-7mol/L;12;5或9;H2A=HA-+H+、HA-⇌A2-+H+;10-3;[Na+]>[A2-]>[HA-];3.25;31;10-35;2.5×10-13
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/9/9 0:0:8组卷:60引用:1难度:0.5


