2022-2023学年上海交大附中高一(下)期末化学试卷(等级考)
发布:2024/6/12 8:0:8
解答题
-
1.工业生产中涉及某些气态化合物是重要的化工原料,如SO2、NH3等有害气体,不能直接排放到大气中,但可以根据它们的性质避害趋利,用来制备多种重要的化学试剂。
(1)为了测定空气中SO2的含量,将空气样品通入盛有400mL0.1mol/L酸性KMnO4溶液的密闭容器中,发生的离子反应方程式为。
(2)若管道中空气流量为aL/min,经过8min溶液恰好褪色,假定样品中SO2被充分吸收,该空气样品中SO2的含量为g/L。(假设空气中其他气体不与酸性KMnO4溶液反应)
如图所示装置,将SO2、Cl2通入SCl2中制备氯化亚砜(SOCl2)。
已知:
①SOCl2是一种液态化合物,沸点为77℃;
②SOCl2遇水剧烈反应,液面上产生白雾,并有刺激性气味的气体产生。
请回答以下问题: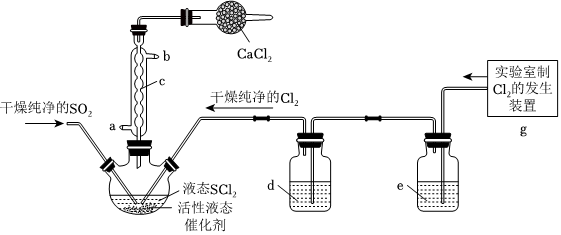
(3)下列固体药品均可与H2SO4反应制备SO2,最不适合的是(单选)。
A.Na2SO3
B.BaSO3
C.Na2S2O3
(4)装置e中的试剂为。
(5)写出制备SOCl2的化学方程式。
(6)若反应中向过量SCl2中共计通入SO2的体积为925mL(S.T.P.),Cl2的体积为896mL(S.T.P.),最后得到产品4.76gSOCl2,则SOCl2的产率(实际产量与理论产量之比)为。
(7)若用碱液吸收工业尾气中的SO2后,得到等物质的量浓度的Na2SO3和NaHSO3溶液。继续向溶液中滴入几滴Ba(OH)2溶液变浑浊,请写出发生反应的离子方程式。
如图转化关系中,A是一种盐,B是气态氢化物,C是单质,F是强酸。且A、B、C、D、E、F中均含有同一种元素。当X无论是强酸还是强碱时都有如图转化关系(其他反应产物及反应所需条件均已略去):
(8)则A物质可以是。组卷:34引用:1难度:0.5
解答题
-
4.食醋的有效成分主要为醋酸(用HAc表示)。25℃时,HAc的Ka=1.75×10-5=10-4.76。某小组研究25℃下HAc电离平衡的影响因素。提出假设:稀释HAc溶液或改变Ac-浓度,HAc电离平衡会发生移动。设计方案并完成实验:用浓度均为0.1mol⋅L-1的HAc和NaAc溶液,按下表配制总体积相同的系列溶液;测定pH,记录数据。
(1)配制250ml0.1000mol⋅L-1的HAc溶液,需要的定量仪器是序号 V(HAc)/ml V(NaAc)/ml V(H2O)/ml n(NaAc):n(HAc) pH Ⅰ 40.00 0 2.86 Ⅱ 4.00 / 36.00 0 3.36 ••• Ⅶ 4.00 a b 3:4 4.53 Ⅷ 4.00 4.00 32.00 1:1 4.65 ,需5mol⋅L-1HAc溶液的体积为mL。
(2)根据表中信息,补充数据:a=,b=。
(3)由实验Ⅰ和Ⅱ可知,稀释HAc溶液,电离平衡(填”正”或”逆”)向移动;结合表中数据,给出判断理由:。
查阅资料获悉:一定条件下,按=1配制的溶液中,[H+]的值等于HAc的Ka对比数据发现,实验Ⅷ中pH=4.65与资料数据Ka=10-4.76存在一定差异;推测可能由HAc浓度不够准确引起,故先准确测定HAc溶液的浓度再验证。n(NaAc)n(HAc)
(4)用移液管取20.00mLHAc溶液于锥形瓶中,加入2滴酚酞溶液,用0.1000mol/LNaOH溶液滴定至终点,判断滴定至终点的现象是。
(5)若测定结果偏低,可能原因是(双选)。
A.滴定管用蒸馏水洗净后未用氢氧化钠润洗
B.盛装待测液的锥形瓶水洗后未烘干
C.滴定过程中振荡锥形瓶时不慎有少量液体溅出
D.滴定前滴定管内无气泡,滴定后滴定管内出现气泡。
(6)滴定过程共消耗NaOH体积为22.08mL,则该HAc溶液的浓度为mol⋅L-1。组卷:28引用:1难度:0.6
解答题
-
5.NaClO溶液具有漂白能力,已知25℃时,Ka(HClO)=4.0×10-8,向含有NaOH的NaClO溶液中逐滴滴入FeSO4溶液,滴加过程中溶液的pH随FeSO4溶液的体积的变化曲线及实验现象见下表。
(1)NaClO的电子式是变化曲线 实验现象 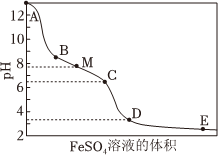
ⅰ.A→B产生红褐色沉淀
ⅱ.B→C红褐色沉淀的量增多
ⅲ.C→D红褐色沉淀的量增多
ⅳ.D点附近产生有刺激性气味的气体
ⅴ.D→E红褐色沉淀的量略有增多,次氯酸钠溶液中离子浓度大小顺序是:。
(2)下列关于NaClO溶液说法正确的是(双选)。
A.0.01mol/L溶液中,[ClO-]<0.01mol⋅L-1
B.长期露置在空气中,释放Cl2,漂白能力减弱
C.通入过量SO2,反应的离子方程式为SO2+ClO-+H2O═+HClOHSO-3
D.25℃,pH=7.0的NaClO和HClO的混合溶液中,[ClO-]=[Na+]
(3)25℃,pH=7.0的NaClO和HClO的混合溶液中,[HClO][ClO-](填<,>或=)。
(4)A→B,C→D过程溶液的pH值下降的原因可用下面的方程式来解释,请推测方框里的物质并在横线上写出完整的方程式并配平:
ClO-+Fe2++□+H2O→Cl-+□。
①。
HClO+□+H2O→Cl-+□+□
②。
(5)已知H2CO3Ka1=4.4×10-7,Ka2=4.7×10-11,少量CO2通入NaClO溶液中发生的离子反应方程式为:。
向pH≈10的含硫废水中加入适量FeSO4溶液,产生黑色沉淀且溶液的pH降低。H2S、HS-、S2-在水溶液中的物质的量含物分数随pH的分布曲线如图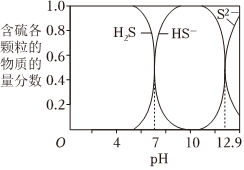
(6)水溶液中存在电离平衡H2S⇌H++HS-和HS-⇌H++S2-。下列关于H2S溶液的说法正确的是(单选)
A.滴加新制氯水,平衡向左移动,溶液pH减小
B.加水,平衡向右移动,溶液中氢离子浓度增大
C.通入过量SO2气体,平衡向左移动,溶液pH增大
D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子的浓度都减小
(7)pH≈10时,溶液中硫元素的主要存在形态为。
(8)用化学平衡移动原理解释向pH≈10的含硫废水中加入FeSO4溶液后pH降低的原因:。
(9)某温度下,CuS和Ag2S饱和溶液中pS和pM的关系如图所示,其中pS=-lg[S2-],pM=-lg[Mn+],Mn+为Cu2+或Ag+,下列说法错误的是(单选)。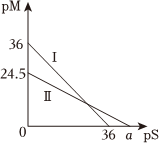
A.曲线Ⅱ代表的是Ag2S
B.a=49
C.此温度下CuS的Ksp=1×10-36
D.此温度下的饱和溶液中[CuS]>[Ag2S]组卷:112引用:3难度:0.5


