2022-2023学年上海中学高一(下)期末化学试卷
发布:2024/8/5 8:0:8
解答题
-
 1.化学反应的本质是化学键的断裂和形成。化学反应通常伴随着热效应。
1.化学反应的本质是化学键的断裂和形成。化学反应通常伴随着热效应。
(1)(单选)下列关于燃料充分燃烧的说法中,错误的是。
A.空气量越多,燃烧效果越好
B.应通入充足且适量的空气
C.固体燃料燃烧前要粉碎
D.液体燃料燃烧时可以以雾状喷出
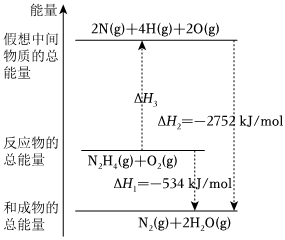
(2)(单选)肼(H2NNH2,各原子间均以单键相连)是一种高能燃料,有关化学反应的能量变化如图所示。已知键能:O=O500kJ⋅mol-1,N-N154kJ⋅mol-1,则N-H键的键能为。
A.194kJ⋅mol-1
B.391kJ⋅mol-1
C.516kJ⋅mol-1
D.658kJ⋅mol-1
(3)(不定项选择)已知反应:
①2C(s)+O2(g)=2CO(g)ΔH=-221kJ⋅mol-1
②稀溶液中,H+(aq)+OH-(aq)=H2O(l)ΔH=-57.3kJ⋅mol-1
③H2(g)+O2(g)=H2O(g)ΔH=-241.8kJ⋅mol-112
④H2O(g)=H2O(l)ΔH=-44.0kJ⋅mol-1
下列结论正确的是。
A.碳的燃烧热大于110.5kJ⋅mol
B.浓硫酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量
C.氢气的燃烧热为241.8kJ⋅mol-1
D.2H2(g)+O2(g)=2H2O(l)ΔH=-571.6kJ⋅mol-1
(4)白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足时生成P4O6,空气充足时生成P4O10。
①已知298K时白磷、红磷完全燃烧的热化学方程式分别为:
P4(s,白磷)+5O2(g)═P4O10(s)ΔH1=-2983.2kJ⋅mol-1
P(s,红磷)+O2(g)═54P4O10(s)ΔH2=-738.5kJ⋅mol-114
则该温度下白磷转化为红磷的热化学方程式为。
②已知298K时白磷不完全燃烧的热化学方程式为P4(s,白磷)+3O2(g)═P4O6(s)ΔH=-1638kJ⋅mol-1。在某密闭容器中加入62g白磷和50.4L氧气(标准状况),控制条件使之恰好完全反应。则所得到的P4O10与P4O6的物质的量之比为,反应过程中放出的热量为。
(5)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
①Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)ΔH1=+64.39kJ⋅mol-1
②2H2O2(l)═2H2O(l)+O2(g)ΔH2=-196.46kJ⋅mol-1
③H2(g)+O2(g)═H2O(l)ΔH3=-285.84kJ⋅mol-112
在H2SO4溶液中,Cu与H2O2反应生成Cu2+和H2O的热化学方程式为。组卷:61引用:1难度:0.6
解答题
-
2.化学能转化为电能,是能量转化的重要形式之一。电能是现代社会中应用广泛、使用方便的一种能源。金属的腐蚀常常与形成原电池有关,因此研究金属腐蚀的成因,建立金属的防护措施具有十分重要的现实意义。
(1)(单选)结合如图装置判断,下列叙述正确的是。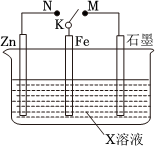
A.若X为NaCl,K与M相连时,石墨电极反应为2Cl--2e-=Cl2↑
B.若X为硫酸,K与M相连时,Fe作负极受到保护
C.若X为硫酸,K与N相连时,溶液中H+向Fe电极移动
D.若X为NaCl,K与N相连时,Fe电极上会有灰绿色沉淀生成,最终变为红褐色
(2)(单选)铜锌原电池(如图)工作时,下列叙述错误的是。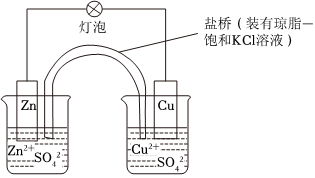
A.负极反应为:Zn-2e-═Zn2+
B.电池总反应为:Zn+Cu2+═Zn2++Cu
C.在外电路中,电子从负极流向正极
D.盐桥中的K+移向ZnSO4溶液
(3)请按要求回答下列问题:
①若电极材料选铜和铁,电解质溶液选氯化铜溶液,外加导线,构成原电池。
请写出电极反应式:负极,正极。
②若某电化学装置总反应为:Cu+2H+=Cu2++H2,则该电池属于原电池还是电解池?。理由是:。
(4)钢铁在自然界中的腐蚀比较普遍。
①远洋轮船的钢铁船体在海水中易发生电化学腐蚀中的腐蚀。为防止这种腐蚀,通常把船体与浸在海水里的Zn块相连,或与直流电源的(填“正”或“负”)极相连。
②利用如图装置,可以模拟铁的电化学防护。若X为碳棒,为减缓铁的腐蚀,开关K应置于处。若X为锌,开关K置于M处,该电化学防护法称为。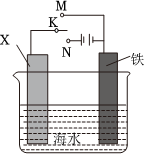
③在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置如图所示,请回答: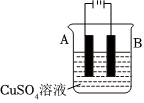
a.应将铁件置于极(填A或B),另一电极材料应为。
b.若电镀前铁、铜两片金属的质量相同,电镀完成后将它们取出洗净、烘干、称量,二者的质量差为5.12g,则电镀时电路中通过的电子为mol。组卷:61引用:1难度:0.6
解答题
-
5.化学反应速率和化学平衡的综合调控对生产、生活和科研有着重要的作用。
(1)(单选)以下说法正确的是。
A.影响化学反应速率的因素只有浓度、压强、温度和催化剂
B.在合成氨反应中使用催化剂能大大提高反应速率,从而提高原料的平衡转化率
C.任何化学反应在一定条件下都存在一定程度的可逆性
D.凡是影响反应速率的因素,都可以使化学平衡发生移动
(2)(单选)少量铁片与100mL0.01mol/L的稀盐酸反应,反应速率太慢.为了加快此反应速率而不改变H2的产量,可以使用如下方法中的。
①加H2O
②加KNO3溶液
③滴入几滴浓盐酸
④加少量铁粉
⑤加NaCl溶液
⑥滴入几滴硫酸铜溶液
⑦升高温度(不考虑盐酸挥发)
⑧改用100mL0.01mol/L盐酸.
A.①⑥⑦
B.③⑤⑧
C.③⑦⑧
D.③④⑥⑦⑧
(3)(单选)某温度下,恒容密闭容器中反应:H2(g)+CO2(g)⇌H2O(g)+CO(g)ΔH>0。已知H2和CO2初始浓度均为0.1mol⋅L-1,平衡时测得H2浓度为0.04mol⋅L-1,下列说法错误的是。
A.反应过程中压强始终保持不变
B.v正(CO2)=v逆(CO)可作为该可逆反应达到平衡状态的标志
C.若达到平衡后移去部分CO2,则平衡向逆反应方向移动
D.若H2(g)、CO2(g)、H2O(g)、CO(g)初始浓度均为0.1mol⋅L-1,则反应逆向进行
(4)(单选)在恒容条件下,能使NO2(g)+CO(g)⇌CO2(g)+NO(g)正反应速率增大且活化分子百分数也增加的措施是。
A.增大NO2或CO的浓度
B.减小CO2或NO的浓度
C.通入Ne使气体的压强增大
D.升高反应的温度
(5)(不定项选择)羰基硫(COS)可作为一种粮食熏蒸剂。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g)⇌COS(g)+H2(g)K=0.1。反应前CO的物质的量为10mol,平衡后CO物质的量为8mol,下列说法正确的是。
A.若升高温度,H2S浓度增加,表明该反应是吸热反应
B.通入CO后,正反应速率瞬间增大随后逐渐减小,逆反应速率逐渐增大
C.反应前H2S物质的量为7mol
D.CO的平衡转化率为80%
(6)把在空气中久置的铝片5.0g投入盛有500mL0.5mol⋅L-1稀硫酸的烧杯中,该铝片与稀硫酸反应产生氢气的速率与反应时间的关系可用如图所示的曲线来表示,回答下列问题: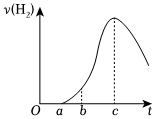
①曲线由O~a段不产生氢气的原因是。
②曲线由a→c段,产生氢气的速率增大的主要原因是。
③曲线从c以后,产生氢气的速率逐渐减小的主要原因是。
(7)工业上除去SO2尾气有多种方法。
常见的烟道气中除去SO2的方法之一:2CO(g)+SO2(g)⇌2CO2(g)+S(l)(ΔH<0)。
①该反应的平衡常数表达式为。若保持其他条件不变,缩小反应容器的体积,平衡常数将会(选填“变大”、“变小”或“不变”)。
②如图是平衡时SO2的质量在不同温度下随压强的变化曲线,判断:T1T2(选填“>”、“<”或“=”)。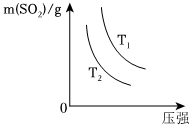
③若在2L的密闭容器中进行上述反应,经测定在5min内气体的质量减小了1.6g,则0~5min的平均反应速率v(CO2)=。组卷:60引用:1难度:0.7
解答题
-
 6.研究化学反应速率和化学平衡,除了能加深对化学反应的认识外,其目的还在于在化工生产、日常生活和科学研究中调控化学反应,使一些需要发生的反应进行得更快、更彻底。
6.研究化学反应速率和化学平衡,除了能加深对化学反应的认识外,其目的还在于在化工生产、日常生活和科学研究中调控化学反应,使一些需要发生的反应进行得更快、更彻底。
(1)硫酸工业生产时,将硫铁矿磨成粉末的目的是,二氧化硫的催化氧化使用作为催化剂,采用常压还是高压条件?。为什么使用该压强?。
(2)氨的合成是最重要的化工生产之一。合成氨实际生产中,常用Fe作催化剂,控制温度773K,压强3.0×105Pa,原料中N2和H2物质的量之比约为1:3。
①合成氨使用该温度的原因是,必须使用高压的原因是。
②该条件下,原料气的平衡转化率低于30%,工业生产时提高原料气总转化率的方法是。
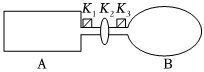
(3)A为导热刚性容器,B为导热的气球。关闭K2,将等量且少量的NO2通过K1、K3分别充入A、B中,反应起始时,A、B的体积相同[已知:2NO2(g)⇌N2O4(g)ΔH<0]。
①一段时间后,反应达到平衡,此时A、B中生成的N2O4的速率是v(A)v(B)(填“>”“<”或“=”);若打开活塞K2,气球B将(填“变大”变小”或“不变”)。
②关闭活塞K2,若在A、B中再充入与初始量相等的NO2,则达到平衡时,NO2的转化率α(A)将(填“增大”“减小”或“不变”);若分别通入等量的氖气,则达到平衡时,A中NO2的转化率将,B中NO2的转化率将(填“变大”“变小”或“不变”)。
③室温下,若A、B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时,中的颜色较深。
④若在容器A中充入4.6g的NO2,达到平衡后容器内混合气体的平均相对分子质量为57.5,则平衡时N2O4的物质的量为。组卷:58引用:1难度:0.6


