化学反应速率和化学平衡的综合调控对生产、生活和科研有着重要的作用。
(1)(单选)以下说法正确的是 CC。
A.影响化学反应速率的因素只有浓度、压强、温度和催化剂
B.在合成氨反应中使用催化剂能大大提高反应速率,从而提高原料的平衡转化率
C.任何化学反应在一定条件下都存在一定程度的可逆性
D.凡是影响反应速率的因素,都可以使化学平衡发生移动
(2)(单选)少量铁片与100mL0.01mol/L的稀盐酸反应,反应速率太慢.为了加快此反应速率而不改变H2的产量,可以使用如下方法中的 CC。
①加H2O
②加KNO3溶液
③滴入几滴浓盐酸
④加少量铁粉
⑤加NaCl溶液
⑥滴入几滴硫酸铜溶液
⑦升高温度(不考虑盐酸挥发)
⑧改用100mL0.01mol/L盐酸.
A.①⑥⑦
B.③⑤⑧
C.③⑦⑧
D.③④⑥⑦⑧
(3)(单选)某温度下,恒容密闭容器中反应:H2(g)+CO2(g)⇌H2O(g)+CO(g)ΔH>0。已知H2和CO2初始浓度均为0.1mol⋅L-1,平衡时测得H2浓度为0.04mol⋅L-1,下列说法错误的是 DD。
A.反应过程中压强始终保持不变
B.v正(CO2)=v逆(CO)可作为该可逆反应达到平衡状态的标志
C.若达到平衡后移去部分CO2,则平衡向逆反应方向移动
D.若H2(g)、CO2(g)、H2O(g)、CO(g)初始浓度均为0.1mol⋅L-1,则反应逆向进行
(4)(单选)在恒容条件下,能使NO2(g)+CO(g)⇌CO2(g)+NO(g)正反应速率增大且活化分子百分数也增加的措施是 DD。
A.增大NO2或CO的浓度
B.减小CO2或NO的浓度
C.通入Ne使气体的压强增大
D.升高反应的温度
(5)(不定项选择)羰基硫(COS)可作为一种粮食熏蒸剂。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g)⇌COS(g)+H2(g)K=0.1。反应前CO的物质的量为10mol,平衡后CO物质的量为8mol,下列说法正确的是 BCBC。
A.若升高温度,H2S浓度增加,表明该反应是吸热反应
B.通入CO后,正反应速率瞬间增大随后逐渐减小,逆反应速率逐渐增大
C.反应前H2S物质的量为7mol
D.CO的平衡转化率为80%
(6)把在空气中久置的铝片5.0g投入盛有500mL0.5mol⋅L-1稀硫酸的烧杯中,该铝片与稀硫酸反应产生氢气的速率与反应时间的关系可用如图所示的曲线来表示,回答下列问题:
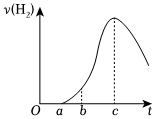
①曲线由O~a段不产生氢气的原因是 硫酸首先与铝片表面的Al2O3反应,不产生H2硫酸首先与铝片表面的Al2O3反应,不产生H2。
②曲线由a→c段,产生氢气的速率增大的主要原因是 反应放热,温度升高是影响反应速率的主要因素,使反应速率增大反应放热,温度升高是影响反应速率的主要因素,使反应速率增大。
③曲线从c以后,产生氢气的速率逐渐减小的主要原因是 硫酸的浓度逐渐减小,该因素变为影响化学反应速率的主要因素,化学反应速率开始下降硫酸的浓度逐渐减小,该因素变为影响化学反应速率的主要因素,化学反应速率开始下降。
(7)工业上除去SO2尾气有多种方法。
常见的烟道气中除去SO2的方法之一:2CO(g)+SO2(g)⇌2CO2(g)+S(l)(ΔH<0)。
①该反应的平衡常数表达式为 c2(CO2)c2(CO)×c(SO2)c2(CO2)c2(CO)×c(SO2)。若保持其他条件不变,缩小反应容器的体积,平衡常数将会 不变不变(选填“变大”、“变小”或“不变”)。
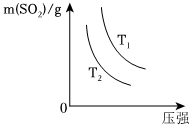
②如图是平衡时SO2的质量在不同温度下随压强的变化曲线,判断:T1<<T2(选填“>”、“<”或“=”)。
③若在2L的密闭容器中进行上述反应,经测定在5min内气体的质量减小了1.6g,则0~5min的平均反应速率v(CO2)=0.01mol/(L min)0.01mol/(L min)。
c
2
(
C
O
2
)
c
2
(
CO
)
×
c
(
S
O
2
)
c
2
(
C
O
2
)
c
2
(
CO
)
×
c
(
S
O
2
)
【答案】C;C;D;D;BC;硫酸首先与铝片表面的Al2O3反应,不产生H2;反应放热,温度升高是影响反应速率的主要因素,使反应速率增大;硫酸的浓度逐渐减小,该因素变为影响化学反应速率的主要因素,化学反应速率开始下降;;不变;<;0.01mol/(L min)
c
2
(
C
O
2
)
c
2
(
CO
)
×
c
(
S
O
2
)
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/8/5 8:0:8组卷:60引用:1难度:0.7
相似题
-
1.氢气最早于16世纪被人工制取出来,氢气是一种清洁能源。
(1)利用光伏电池电解水制H2是氢能的重要来源。已知:H-H键、O=O键、H-O键的键能依次为436kJ•mol-1、495kJ•mol-1、463kJ•mol-1。则2H2O(g)═2H2(g)+O2(g)△H=kJ•mol-1。
(2)T1℃时,向5L恒容密闭容器中充入0.5molCH4,只发生反应2CH4(g)⇌C2H4(g)+2H2(g),达到平衡时,测得c(C2H4)=2c(CH4),CH4的转化率为;保持其他条件不变,温度改为T2℃,经25s后达到平衡,测得c(CH4)=2c(C2H4),则0~25s内v(C2H4)=mol•L-1•s-1。
(3)CH4分解时几种气体的平衡分压(pPa)的对数值lgp与温度的关系如图所示。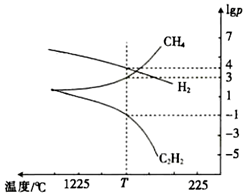
①T℃时,向一恒容密闭容器中通入一定量的CH4(g)、C2H4(g)和H2(g),只发生反应2CH4(g)⇌C2H2(g)+3H2(g)ΔH,ΔH(填“>”或“<”)0,此时的平衡常数Kp=(用平衡分压代替浓度进行计算)Pa2。
②若只改变一个反应条件使Kp变大,则该条件是(填标号)。
A.减小C2H2的浓度
B.升高温度
C.增大压强
D.加入合适的催化剂
(4)工业上,以KNH2和液氨为电解质,以石墨为电极,电解液氨制备H2。阳极的电极反应式为,一段时间后阴、阳两极收集到的气体质量之比为。发布:2025/1/4 8:0:1组卷:9引用:3难度:0.5 -
2.反应 4A(g)+5B(g)⇌4C(g)+6D(g)在 5L 的密闭容器中进行,半分钟后,C 的物质的量增 加了 0.30mol。下列叙述正确的是( )
发布:2024/12/30 19:30:2组卷:67引用:6难度:0.6 -
3.将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)⇌xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率为0.1mol/(L•min).求:
(1)此时A的浓度c(A)=mol/L,反应开始前容器中的A、B的物质的量:n(A)=n(B)=mol;
(2)B的平均反应速率v(B)=mol/(L•min);
(3)x的值为.发布:2024/12/30 19:0:1组卷:163引用:26难度:0.3


