化学能转化为电能,是能量转化的重要形式之一。电能是现代社会中应用广泛、使用方便的一种能源。金属的腐蚀常常与形成原电池有关,因此研究金属腐蚀的成因,建立金属的防护措施具有十分重要的现实意义。
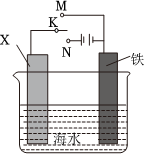
(1)(单选)结合如图装置判断,下列叙述正确的是 CC。
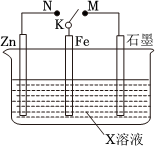
A.若X为NaCl,K与M相连时,石墨电极反应为2Cl--2e-=Cl2↑
B.若X为硫酸,K与M相连时,Fe作负极受到保护
C.若X为硫酸,K与N相连时,溶液中H+向Fe电极移动
D.若X为NaCl,K与N相连时,Fe电极上会有灰绿色沉淀生成,最终变为红褐色
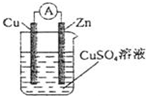
(2)(单选)铜锌原电池(如图)工作时,下列叙述错误的是 DD。
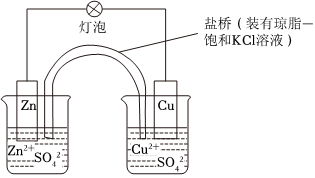
A.负极反应为:Zn-2e-═Zn2+
B.电池总反应为:Zn+Cu2+═Zn2++Cu
C.在外电路中,电子从负极流向正极
D.盐桥中的K+移向ZnSO4溶液
(3)请按要求回答下列问题:
①若电极材料选铜和铁,电解质溶液选氯化铜溶液,外加导线,构成原电池。
请写出电极反应式:负极 Fe-2e-=Fe2+Fe-2e-=Fe2+,正极 Cu2++2e-=CuCu2++2e-=Cu。
②若某电化学装置总反应为:Cu+2H+=Cu2++H2,则该电池属于原电池还是电解池?电解池电解池。理由是:该反应不能自发进行,不能通过原电池反应实现,只能通过电解池反应实现该反应不能自发进行,不能通过原电池反应实现,只能通过电解池反应实现。
(4)钢铁在自然界中的腐蚀比较普遍。
①远洋轮船的钢铁船体在海水中易发生电化学腐蚀中的 吸氧吸氧腐蚀。为防止这种腐蚀,通常把船体与浸在海水里的Zn块相连,或与直流电源的 负负(填“正”或“负”)极相连。
②利用如图装置,可以模拟铁的电化学防护。若X为碳棒,为减缓铁的腐蚀,开关K应置于 NN处。若X为锌,开关K置于M处,该电化学防护法称为 牺牲阳极法牺牲阳极法。
③在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置如图所示,请回答:
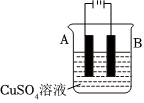
a.应将铁件置于 BB极(填A或B),另一电极材料应为 CuCu。
b.若电镀前铁、铜两片金属的质量相同,电镀完成后将它们取出洗净、烘干、称量,二者的质量差为5.12g,则电镀时电路中通过的电子为 0.040.04mol。
【考点】原电池与电解池的综合.
【答案】C;D;Fe-2e-=Fe2+;Cu2++2e-=Cu;电解池;该反应不能自发进行,不能通过原电池反应实现,只能通过电解池反应实现;吸氧;负;N;牺牲阳极法;B;Cu;0.04
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/8/5 8:0:8组卷:61引用:1难度:0.6