CH4既是一种重要的能源,也是一种重要的化工原料。
(1)甲烷高温分解生成氢气和碳的反应是吸热反应。在密闭容器中进行此反应时要通入适量空气使部分甲烷燃烧,其目的是 提供CH4分解所需的能量提供CH4分解所需的能量。
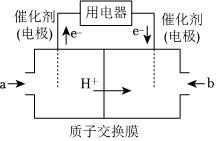
(2)以CH4为燃料可设计成结构简单、能量转化率高的燃料电池,其工作原理如图所示,则通入b气体的电极名称为 正极正极(选填“正极”或“负极”),通入a气体的电极反应式 CH4-8e-+2H2O=CO2↑+8H+CH4-8e-+2H2O=CO2↑+8H+(质子交换膜只允许H+通过)。
(3)在一定温度和催化剂作用下,CH4与CO2可直接转化成乙酸,这是实现“减排”的种研究方向。
①CH4与CO2可直接转化成乙酸的原子利用率为 100%100%。
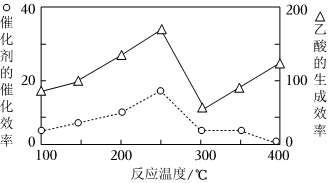
②在不同温度下,催化剂的催化效率与乙酸的生成速率如图所示,则该反应的最佳温度应控制在 250℃250℃左右。
(4)碳正离子(例如:CH+5、CH+3、(CH3)3C+等)是有机反应中间体,CH+5碳正离子是由CH4在“超强酸”中获得一个H+而得到,而CH+5失去H2可得CH+3。(CH3)3C+去掉H+后生成电中性有机分子,该分子的结构简式为 (CH3)2C═CH2(CH3)2C═CH2。
(5)CH4与Cl2生成CH3Cl的反应过程,中间态物质的能量关系如图所示。下列有关说法中正确的是 ACAC(填序号)。
A.Cl•是Cl2在光照下化学键断裂生成的,该过程吸收能量
B.图示反应过程一定无CH3CH3生成
C.图示生成CH3Cl过程为放热过程
D.图示过程分两步,第一步既有极性键断裂,又有非极性键断裂
CH
+
5
CH
+
3
CH
+
5
CH
+
5
CH
+
3
【答案】提供CH4分解所需的能量;正极;CH4-8e-+2H2O=CO2↑+8H+;100%;250℃;(CH3)2C═CH2;AC
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/9/6 4:0:8组卷:16引用:2难度:0.7