(1)氮氧化物是形成光化学烟雾和酸雨的一个重要原因,用CH4催化还原NO,可在一定程度上消除氮氧化物的污染。

已知:CH4(g)+4NO(g)⇌2N2(g)+CO2(g)+2H2O(g) ΔH=-1160kJ•mol-1
2NO2(g)+N2(g)⇌4NO(g) ΔH=+293kJ•mol-1
则该条件下,CH4催化还原NO2消除污染的热化学方程式为 CH4(g)+2NO2(g)⇌N2(g)+CO2(g)+2H2O(g)ΔH=-867kJ/molCH4(g)+2NO2(g)⇌N2(g)+CO2(g)+2H2O(g)ΔH=-867kJ/mol。
(2)NH3的空间构型为 三角锥形三角锥形,CH2O中C采取的杂化类型为 sp2sp2。CH2O中碳氢键与NH3中氮氢键相比,键长较长的是 C-H键C-H键。
(3)乙炔(CH≡CH)是重要的化工原料。工业上可用甲烷裂解法制取乙炔:2CH4(g)⇌C2H2(g)+3H2(g) 同时发生副反应:2CH4(g)⇌C2H4(g)+2H2(g);甲烷裂解时,几种气体平衡时分压(Pa)的对数即lgp与温度(℃)之间的关系如图甲所示。根据图判断,反应2CH4(g)⇌C2H2(g)+3H2(g) ΔH >>0(填“>”或“<”)。1725℃时,向恒容密闭容器中充入CH4,达到平衡时CH4生成C2H2的平衡转化率为 62.5%62.5%。该温度下,2CH4(g)⇌C2H4(g)+2H2(g)的平衡常数Kp=102.4Pa102.4Pa[注:用平衡分压(Pa)代替平衡浓度(mol•L-1)进行计算]。
(4)利用在特定条件下用铂电极(阳极为铂丝)电解饱和硫酸氢钾溶液的方法(图乙)制备K2S2O8(过二硫酸钾)。在低温下电解液中主要含有K+、H+和HSO-4离子,电流通过溶液后发生反应。阳极区电极反应式为 2HSO-4-2e-=S2O2-8+2H+2HSO-4-2e-=S2O2-8+2H+,X为 质子质子交换膜(填“质子”、“阳离子”或“阴离子”),当电路中通过0.2mole-时,两边溶液质量的变化差为 0.2g0.2g。
HSO
-
4
HSO
-
4
O
2
-
8
HSO
-
4
O
2
-
8
【答案】CH4(g)+2NO2(g)⇌N2(g)+CO2(g)+2H2O(g)ΔH=-867kJ/mol;三角锥形;sp2;C-H键;>;62.5%;102.4Pa;2-2e-=S2+2H+;质子;0.2g
HSO
-
4
O
2
-
8
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/8/6 8:0:9组卷:27引用:1难度:0.5
相似题
-
1.氢气最早于16世纪被人工制取出来,氢气是一种清洁能源。
(1)利用光伏电池电解水制H2是氢能的重要来源。已知:H-H键、O=O键、H-O键的键能依次为436kJ•mol-1、495kJ•mol-1、463kJ•mol-1。则2H2O(g)═2H2(g)+O2(g)△H=kJ•mol-1。
(2)T1℃时,向5L恒容密闭容器中充入0.5molCH4,只发生反应2CH4(g)⇌C2H4(g)+2H2(g),达到平衡时,测得c(C2H4)=2c(CH4),CH4的转化率为;保持其他条件不变,温度改为T2℃,经25s后达到平衡,测得c(CH4)=2c(C2H4),则0~25s内v(C2H4)=mol•L-1•s-1。
(3)CH4分解时几种气体的平衡分压(pPa)的对数值lgp与温度的关系如图所示。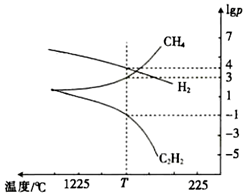
①T℃时,向一恒容密闭容器中通入一定量的CH4(g)、C2H4(g)和H2(g),只发生反应2CH4(g)⇌C2H2(g)+3H2(g)ΔH,ΔH(填“>”或“<”)0,此时的平衡常数Kp=(用平衡分压代替浓度进行计算)Pa2。
②若只改变一个反应条件使Kp变大,则该条件是(填标号)。
A.减小C2H2的浓度
B.升高温度
C.增大压强
D.加入合适的催化剂
(4)工业上,以KNH2和液氨为电解质,以石墨为电极,电解液氨制备H2。阳极的电极反应式为,一段时间后阴、阳两极收集到的气体质量之比为。发布:2025/1/4 8:0:1组卷:9引用:3难度:0.5 -
2.反应 4A(g)+5B(g)⇌4C(g)+6D(g)在 5L 的密闭容器中进行,半分钟后,C 的物质的量增 加了 0.30mol。下列叙述正确的是( )
发布:2024/12/30 19:30:2组卷:67引用:6难度:0.6 -
3.将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)⇌xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率为0.1mol/(L•min).求:
(1)此时A的浓度c(A)=mol/L,反应开始前容器中的A、B的物质的量:n(A)=n(B)=mol;
(2)B的平均反应速率v(B)=mol/(L•min);
(3)x的值为.发布:2024/12/30 19:0:1组卷:163引用:26难度:0.3


