金属铍【Be】是原子能、火箭、导弹、航空、宇宙航行以及冶金工业中不可缺少的宝贵材料,有着“超级金属”之称,制备金属铍的原料是绿柱石,其主要成分有BeO、Al2O3、SiO2、Fe2O3和FeO,制备工艺流程如图所示,已知:①“氧化”时发生反应:2FeSO4+H2SO4+H2O2═Fe2(SO4)3+2H2O
②(NH4)2BeF4易溶于水,且在水中的溶解度随温度升高显著增大。
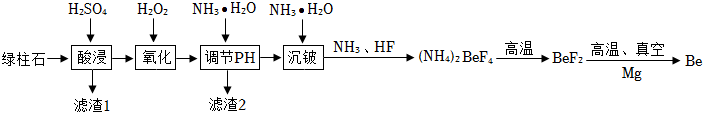
请回答问题:
(1)写出“酸浸”时FeO发生反应的化学方程式 FeO+H2SO4=FeSO4+H2OFeO+H2SO4=FeSO4+H2O;
(2)写出“酸浸”后得到的滤液1中的金属离子 Be2+、Al3+、Fe3+、Fe2+Be2+、Al3+、Fe3+、Fe2+(写离子符号);
(3)滤渣2的主要成分是Fe(OH)3和 Al(OH)3Al(OH)3(填化学式);
(4)(NH4)2BeF4溶液经蒸发浓缩、降温结晶降温结晶、过滤、洗涤、干燥等操作后可得到(NH4)2BeF4晶体;
(5)写出在“高温、真空”条件下发生置换反应得到Be化学反应方程式 Mg+BeF2高温、真空 MgF2+BeMg+BeF2高温、真空 MgF2+Be;
(6)铍的表面易形成致密氧化膜。由此预测铍的金属活动性比铜 强强(填“强”或“弱”)。将未经打磨的铍丝放入装有少量盐酸的试管中,若观察到 一开始无气体生成,后产生大量气泡一开始无气体生成,后产生大量气泡(填实验现象),说明预测正确;
(7)用绿柱石生产出akg金属铍,理论上需要在“沉铍”环节消耗HF 80a980a9kg。
M
g
+
B
e
F
2
高温
、
真空
M
g
F
2
+
B
e
M
g
+
B
e
F
2
高温
、
真空
M
g
F
2
+
B
e
80
a
9
80
a
9
【考点】物质的相互转化和制备;根据化学反应方程式的计算.
【答案】FeO+H2SO4=FeSO4+H2O;Be2+、Al3+、Fe3+、Fe2+;Al(OH)3;降温结晶; ;强;一开始无气体生成,后产生大量气泡;
M
g
+
B
e
F
2
高温
、
真空
M
g
F
2
+
B
e
80
a
9
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/8/30 0:0:8组卷:118引用:2难度:0.5
相似题
-
1.新冠肺炎疫情防控期间,西安市各学校开展全域喷洒低浓度、有效成分是次氯酸钠的“84”消毒液进行消毒。如图所示是模拟制备“84”消毒液的流程(Cl2是一种黄绿色的有毒气体)。请回答下列问题:
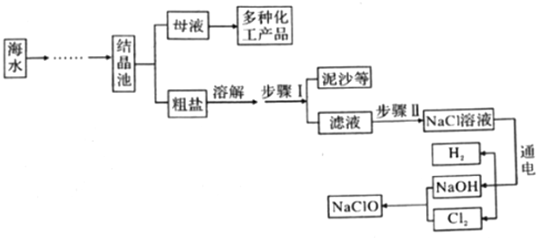
(1)NaOH的俗称为(写一种)。
(2)步骤Ⅱ中,通常用碳酸钠溶液除去滤液中的氯化钙杂质,请写出有关反应的化学方程式。
(3)电解水时,一般在水中加入少量NaOH以增强水的导电性,不能加入NaCl的原因是。发布:2025/1/3 8:0:1组卷:6引用:1难度:0.5 -
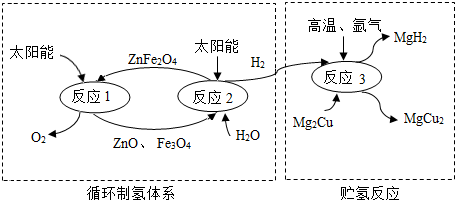 2.如图是制取与贮存氢气的一种方法,Mg2Cu是一种贮氢合金,吸氢后生成MgH2和MgCu2合金的混合物(M),MgH2+2HCl═MgCl2+2H2↑,下列说法不正确的是( )发布:2024/12/31 8:0:1组卷:48引用:2难度:0.5
2.如图是制取与贮存氢气的一种方法,Mg2Cu是一种贮氢合金,吸氢后生成MgH2和MgCu2合金的混合物(M),MgH2+2HCl═MgCl2+2H2↑,下列说法不正确的是( )发布:2024/12/31 8:0:1组卷:48引用:2难度:0.5 -
3.某种家用的消毒液的主要成分是次氯酸钠(NaClO),制取NaClO的化学方程式为:Cl2+2NaOH=NaClO+NaCl+H2O,下列说法错误的是( )
发布:2025/1/3 8:0:1组卷:71引用:1难度:0.7


