氢能是极具发展潜力的清洁能源,2021年我国制氢量位居世界第一。请回答:
(1)298K时,1gH2燃烧生成H2O(g)放热121kJ,1molH2O(l)蒸发吸热44kJ,表示H2燃烧热的热化学方程式为 H2(g)+12O2(g)=H2O(l)ΔH=-286kJ•mol-1H2(g)+12O2(g)=H2O(l)ΔH=-286kJ•mol-1。
(2)工业上,常用CH4(g)与H2O(g)重整制备H2(g)。500℃时,主要发生下列反应:
Ⅰ.CH4(g)+H2O(g)⇌CO(g)+3H2(g)
Ⅱ.CO(g)+H2O(g)⇌CO2(g)+H2(g)
①已知:CaO(s)+CO2(g)═CaCO3(s)ΔH=-178.8kJ•mol-1。向重整反应体系中加入适量多孔CaO,其优点是 吸收二氧化碳有利于平衡正向移动,从而提高甲烷的转化率吸收二氧化碳有利于平衡正向移动,从而提高甲烷的转化率。
②下列操作中,能提高CH4(g)平衡转化率的是 CDCD(填标号)。
A.加催化剂
B.增加CH4(g)用量
C.移除H2(g)
D.恒温恒压,通入惰性气体
③500℃、恒压(P0)条件下,1molCH4(g)和1molH2O(g)反应达平衡时,CH4(g)的转化率为0.5,CO2(g)的物质的量为0.25mol,则反应Ⅱ的平衡常数Kp=77(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
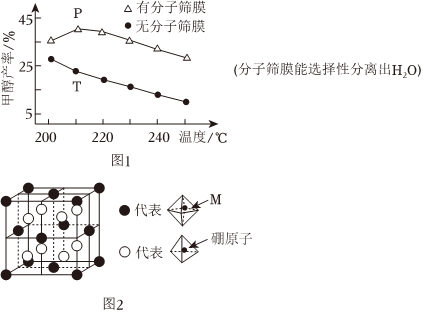
(3)实现碳达峰、碳中和是贯彻新发展理念的内在要求,因此二氧化碳的合理利用成为研究热点。可用氢气和二氧化碳在催化剂作用下合成甲醇:CO2+3H2⇌CH3OH+H2O。恒压下,CO2和H2的起始物质的量之比为1:3时,该反应甲醇的平衡产率随温度的变化如图1所示。该反应的ΔH <<0,甲醇的产率P点高于T点的原因为 P点有分子筛膜,分离出水有利于平衡正向移动,从而提高甲醇的产率P点有分子筛膜,分离出水有利于平衡正向移动,从而提高甲醇的产率。
(4)某种新型储氢材料的晶胞如图2,八面体中心为M金属离子,顶点均为NH3配体:四面体中心为硼原子,顶点均为氢原子。若其摩尔质量为188g•mol-1,则M元素为 FeFe(填元素符号);在该化合物中,M离子的价电子排布式为 3d63d6。
1
2
1
2
【答案】H2(g)+O2(g)=H2O(l)ΔH=-286kJ•mol-1;吸收二氧化碳有利于平衡正向移动,从而提高甲烷的转化率;CD;7;<;P点有分子筛膜,分离出水有利于平衡正向移动,从而提高甲醇的产率;Fe;3d6
1
2
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/9/26 4:0:1组卷:41引用:4难度:0.5
相似题
-
1.氢气最早于16世纪被人工制取出来,氢气是一种清洁能源。
(1)利用光伏电池电解水制H2是氢能的重要来源。已知:H-H键、O=O键、H-O键的键能依次为436kJ•mol-1、495kJ•mol-1、463kJ•mol-1。则2H2O(g)═2H2(g)+O2(g)△H=kJ•mol-1。
(2)T1℃时,向5L恒容密闭容器中充入0.5molCH4,只发生反应2CH4(g)⇌C2H4(g)+2H2(g),达到平衡时,测得c(C2H4)=2c(CH4),CH4的转化率为;保持其他条件不变,温度改为T2℃,经25s后达到平衡,测得c(CH4)=2c(C2H4),则0~25s内v(C2H4)=mol•L-1•s-1。
(3)CH4分解时几种气体的平衡分压(pPa)的对数值lgp与温度的关系如图所示。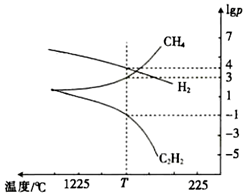
①T℃时,向一恒容密闭容器中通入一定量的CH4(g)、C2H4(g)和H2(g),只发生反应2CH4(g)⇌C2H2(g)+3H2(g)ΔH,ΔH(填“>”或“<”)0,此时的平衡常数Kp=(用平衡分压代替浓度进行计算)Pa2。
②若只改变一个反应条件使Kp变大,则该条件是(填标号)。
A.减小C2H2的浓度
B.升高温度
C.增大压强
D.加入合适的催化剂
(4)工业上,以KNH2和液氨为电解质,以石墨为电极,电解液氨制备H2。阳极的电极反应式为,一段时间后阴、阳两极收集到的气体质量之比为。发布:2025/1/4 8:0:1组卷:9引用:3难度:0.5 -
2.反应 4A(g)+5B(g)⇌4C(g)+6D(g)在 5L 的密闭容器中进行,半分钟后,C 的物质的量增 加了 0.30mol。下列叙述正确的是( )
发布:2024/12/30 19:30:2组卷:67引用:6难度:0.6 -
3.将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)⇌xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率为0.1mol/(L•min).求:
(1)此时A的浓度c(A)=mol/L,反应开始前容器中的A、B的物质的量:n(A)=n(B)=mol;
(2)B的平均反应速率v(B)=mol/(L•min);
(3)x的值为.发布:2024/12/30 19:0:1组卷:163引用:26难度:0.3


