碘及其化合物广泛用于医药、染料等方面。碘酸是一种强酸,其水溶液有强氧化性.已知氧化性:Cl2>HIO3>Fe3+>I2。回答下列问题:
(1)一种以含有少量I-的废液为原料制备I2的方法如图所示:
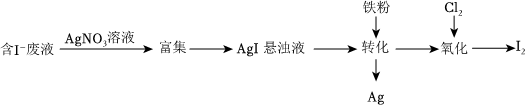
①“转化”生成的Ag溶于稀硝酸可获得硝酸银,写出Ag与稀硝酸反应的离子方程式:3Ag+4H++NO-3=3Ag++NO↑+2H2O3Ag+4H++NO-3=3Ag++NO↑+2H2O。
②通入Cl2的过程中,若n(Cl2)n(FeI2)=12,则反应中被氧化的元素为 II(填元素符号);当n(Cl2)n(FeI2)>1.5后,单质碘的产率会降低,原因是 I2进一步被Cl2氧化,产率降低I2进一步被Cl2氧化,产率降低。
(2)大量的碘由自然界的NaIO3与还原剂NaHSO3反应制得,则该制备I2的反应中的氧化剂和还原剂的物质的量之比为 2:52:5。
(3)卤素互化物IF5可发生水解反应,生成卤离子和卤氧离子(为非氧化还原反应),写出反应的离子方程式:IF5+3H2O=5HF+IO-3+H+IF5+3H2O=5HF+IO-3+H+。
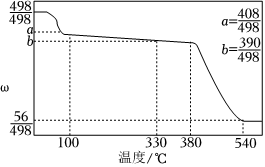
(4)碘酸钙是食品及饲料添加剂中补碘补钙的常用试剂,微溶于水.Ca(IO3)2⋅6H2O加热升温过程中剩余固体的质量分数w(剩余固体的质量原始固体的质量)随温度变化的关系如图所示。为获得无水碘酸钙,可将Ca(IO3)2⋅6H2O晶体 在330~380℃条件下加热至恒重在330~380℃条件下加热至恒重(填实验操作)。若将加热温度提高至540℃,则此时得到固体的主要成分为 CaOCaO(填化学式)。
NO
-
3
NO
-
3
n
(
C
l
2
)
n
(
F
e
I
2
)
=
1
2
n
(
C
l
2
)
n
(
F
e
I
2
)
IO
-
3
IO
-
3
w
(
剩余固体的质量
原始固体的质量
)
【答案】3Ag+4H++=3Ag++NO↑+2H2O;I;I2进一步被Cl2氧化,产率降低;2:5;IF5+3H2O=5HF++H+;在330~380℃条件下加热至恒重;CaO
NO
-
3
IO
-
3
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/8/29 0:0:8组卷:19引用:5难度:0.5
相似题
-
1.下面是某加碘食盐包装袋上的部分图表文字(I为碘元素符号).由此,你得到的信息和作出的推测是( )
 发布:2024/11/6 8:0:1组卷:7引用:2难度:0.7
发布:2024/11/6 8:0:1组卷:7引用:2难度:0.7 -
2.碘及其化合物在生产、生活、医疗和实验分析等方面都有重要应用.回答下列问题.
(1)碘酒中的分散质粒子的大小为(天标号).
a.小于1nm b.大于100nm c.在1~100n之间 d.100nm
(2)等浓度、等体积的次碘酸(HIO)溶液与NaOH溶液混合后溶液呈碱性,则次碘酸在水中的电离方程式,该混合溶液呈弱碱性的原因是(用离子方程式表示).
(3)碘酸碘是一种由碘元素和氧元素组成的化合物,碘的化合价为+3、+5两种价态,则碘酸碘的摩尔质量是.
(4)加碘食盐中的碘以碘酸钾(KIO3)形式存在,取少量加碘食盐溶于水,再加入稀硫酸、KI溶液和淀粉溶液,溶液变蓝,反应的离子方程式是.据此反应,可用试纸和生活中常见的物质进行实验分析,证明加碘食盐中存在,可供选择的物质有:①自来水、②蓝色石蕊试纸、③碘化钾淀粉试纸、④白糖、⑤食醋、⑥白酒.进行以上实验分析时,除需要用到加碘食盐外,还必须使用到的物质是IO-3(填序号),具体操作是.发布:2024/10/26 17:0:2组卷:2引用:0难度:0.9 -
3.人类的衣食住行都离不开化学,化学与生活密切相关.在我们的日常生活中出现了“加碘食盐”、“加铁酱油”、“含氟牙膏”等商品.请回答:
(1)“含氟牙膏”中的氟应理解为(填序号).
①元素 ②单质
(2)“加铁酱油”中的铁属于(填序号).
①营养强化剂 ②着色剂
(3)“加碘食盐”中的碘主要以碘酸钾形式存在,其中碘元素的化合价是.
测定“加碘食盐”中碘元素含量的一种方法如下:称取50.0g食盐溶于适量水,加入过量碘化钾和稀硫酸,其反应的化学方程式为:
KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O
若测得生成3.0×10-5 mol I2,则该食盐中碘元素的含量是mg/kg.(精确至0.1)发布:2024/11/15 8:0:2组卷:15引用:1难度:0.3


