某化学兴趣小组欲在实验室探究氯气的性质及模拟工业制取漂白粉,设计了如图装置进行实验。
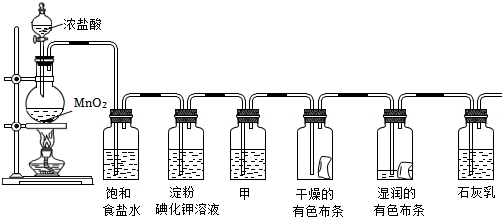
(1)圆底烧瓶内发生的离子方程式为 MnO2+4H++2Cl-(浓) △ Mn2++Cl2↑+2H2OMnO2+4H++2Cl-(浓) △ Mn2++Cl2↑+2H2O。
(2)饱和食盐水的作用为 除去Cl2中混有的HCl除去Cl2中混有的HCl,淀粉碘化钾溶液中发生的离子反应为 Cl2+2I-=2Cl-+I2Cl2+2I-=2Cl-+I2。
(3)若干燥的有色布条不褪色,湿润的有色布条褪色,则甲中盛放 浓硫酸浓硫酸。
(4)Cl2与石灰乳反应制取漂白粉的化学方程式为 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O。
(5)用下列两种方法制取氯气,则所得氯气 AA。
①用含氯化氢146克的浓盐酸与足量的二氧化锰反应
②用87克二氧化锰与足量的浓盐酸反应
A.②比①多
B.①比②多
C.一样多
D.无法比较
(6)Cl2是一种有毒气体,如果泄漏会造成严重的危害。已知3Cl2+8NH3═6NH4Cl+N2,化工厂可用浓氨水来检验Cl2是否泄漏。反应中被氧化和未被氧化的NH3分子个数比为 1:31:3。
(7)将Cl2通入热的烧碱溶液中,可以得到NạCl、NaClO和NaClO3的混合液。当NaCl和NaClO3的物质的量之比为15:2时反应的离子方程式为 11Cl2+22OH-=15Cl-+5ClO-+2ClO-3+11H2O11Cl2+22OH-=15Cl-+5ClO-+2ClO-3+11H2O。
△
△
C
l
O
-
3
C
l
O
-
3
【答案】MnO2+4H++2Cl-(浓) Mn2++Cl2↑+2H2O;除去Cl2中混有的HCl;Cl2+2I-=2Cl-+I2;浓硫酸;2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;A;1:3;11Cl2+22OH-=15Cl-+5ClO-+2+11H2O
△
C
l
O
-
3
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/10/17 12:0:2组卷:53引用:1难度:0.6
相似题
-
1.如图是某同学设计的氯气制备及性质验证实验装置。相关说法正确的是( )
 发布:2025/1/15 8:0:2组卷:20引用:2难度:0.8
发布:2025/1/15 8:0:2组卷:20引用:2难度:0.8 -
2.为了验证干燥的氯气无漂白性,湿润的氯气具有漂白性,某同学设计实验如图.其中B、C、D、E、F分别盛有饱和食盐水、浓硫酸.干燥红色布条、浓硫酸、湿润红色布条.
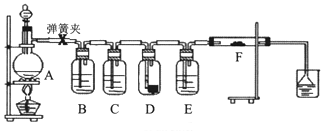
请回答:
(1)E中浓硫酸的作用.
(2)将F中的湿润布条换成卷曲的细铜丝,并用酒精灯加热,可看到的现象是.
(3)若用装置A制取2.24L(标况)氯气,消耗10mol/L浓盐酸的体积明显大于40mL,造成该结果的可能原因有.
A.浓盐酸的挥发 B.随反应进行盐酸浓度下降
C.加热时火力不够猛 D.MnO2固体过量.发布:2025/1/15 8:0:2组卷:17引用:1难度:0.3 -
3.实验室中模拟用甲烷与氯气反应得到的副产品来制取盐酸,原理如图,下列说法不正确的是( )
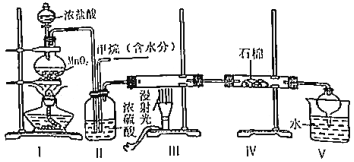 发布:2024/12/30 17:0:5组卷:61引用:1难度:0.7
发布:2024/12/30 17:0:5组卷:61引用:1难度:0.7


