 在学习“酸碱中和反应”时,同学们发现稀盐酸与氢氧化钠溶液混合后没有明显的现象,某兴趣小组的同学为了证明是否发生了化学反应,进行了如下探究:
在学习“酸碱中和反应”时,同学们发现稀盐酸与氢氧化钠溶液混合后没有明显的现象,某兴趣小组的同学为了证明是否发生了化学反应,进行了如下探究:
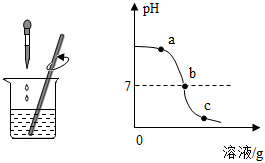
(1)准备了一定量氢氧化钠溶液和稀盐酸,向一种溶液中滴加另一种溶液,用pH传感器测得溶液的pH变化如图所示,从曲线变化可知,盐酸和氢氧化钠溶液发生了反应,回答下列问题。
①滴管中的溶液是 盐酸盐酸。
②a点时,溶液中的溶质是 NaCl、NaOHNaCl、NaOH(写化学式)。
③从微观的角度分析,该反应的实质是 氢离子和氢氧根离子结合成水分子或H++OH-=H2O氢离子和氢氧根离子结合成水分子或H++OH-=H2O。
【交流讨论】大家讨论认为,如果盐酸和氢氧化钠减少(或消失),或有新物质生成,都能证明反应发生。
(2)【实验设计】对反应后的溶液,同学们进行了如下实验探究:
| 实验方案 | 一 | 二 | 三 |
| 实验操作 |
|
|
|
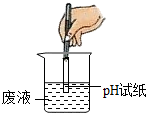
| 预期的现象 | 与标准比色卡对比pH<7 |
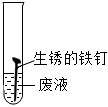
有气泡产生,溶液由无色变成浅绿色 有气泡产生,溶液由无色变成浅绿色
|
红棕色消失,溶液由无色变成黄色 红棕色消失,溶液由无色变成黄色
|
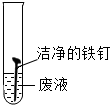
| 实验结论 | 废液中含有HCl | 废液中含有HCl | 废液中含有HCl反应的化学方程式为 Fe2O3+6HCl=2FeCl3+3H2O Fe2O3+6HCl=2FeCl3+3H2O |
(3)【评价与反思】实验结束后,同学们对探究活动进行了如下反思:
①小强认为方案一中存在操作错误,错误的操作是
把pH试纸伸入到待测液中
把pH试纸伸入到待测液中
。②大家一致认为实验后的废液不能直接排放,理由是
会腐蚀铁质下水管道或污染环境等
会腐蚀铁质下水管道或污染环境等
(写一点)。【考点】中和反应及其应用;溶液的酸碱性与pH的关系.
【答案】盐酸;NaCl、NaOH;氢离子和氢氧根离子结合成水分子或H++OH-=H2O;有气泡产生,溶液由无色变成浅绿色;红棕色消失,溶液由无色变成黄色;Fe2O3+6HCl=2FeCl3+3H2O;把pH试纸伸入到待测液中;会腐蚀铁质下水管道或污染环境等
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/7/10 8:0:8组卷:70引用:2难度:0.5
相似题
-
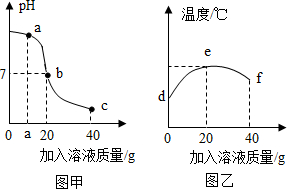 1.某校化学小组在利用盐酸和氢氧化钠溶液探究酸碱中和反应时,利用数字化传感器测得烧杯中溶液pH的变化图像如图甲所示,溶液的温度变化如图乙所示(不考虑反应过程中热量损失)。下列说法错误的是( )发布:2024/12/25 17:0:2组卷:70引用:3难度:0.6
1.某校化学小组在利用盐酸和氢氧化钠溶液探究酸碱中和反应时,利用数字化传感器测得烧杯中溶液pH的变化图像如图甲所示,溶液的温度变化如图乙所示(不考虑反应过程中热量损失)。下列说法错误的是( )发布:2024/12/25 17:0:2组卷:70引用:3难度:0.6 -
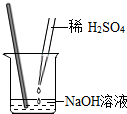 2.小明同学用如图所示的方法做酸碱中和实验,采用酚酞试液作指示剂,恰好完全中和时溶液的颜色为( )发布:2024/12/25 17:0:2组卷:68引用:3难度:0.9
2.小明同学用如图所示的方法做酸碱中和实验,采用酚酞试液作指示剂,恰好完全中和时溶液的颜色为( )发布:2024/12/25 17:0:2组卷:68引用:3难度:0.9 -
3.某研究性学习小组为了探究氢氧化钠溶液与稀硫酸是否恰好完全反应,分别取少量反应后的溶液于试管中,用下表中的不同试剂进行实验.下列选项正确的是( )
选项 所用试剂 现象和结论 A 硫酸铜溶液 出现蓝色沉淀,则氢氧化钠过量 B 氯化钡溶液 出现白色沉淀,则硫酸过量 C 铜丝 有气泡产生,则硫酸过量 D 无色酚酞溶液 溶液不变色,则恰好完全反应 发布:2024/12/25 17:30:2组卷:46引用:2难度:0.7


