一定条件下,水气变换反应CO+H2O⇌CO2+H2的中间产物是HCOOH。为探究该反应过程,研究HCOOH水溶液在密封石英管中的分解反应:
Ⅰ.HCOOH⇌CO+H2O(快)
Ⅱ.HCOOH⇌CO2+H2(慢)
研究发现,在反应Ⅰ、Ⅱ中,H+仅对反应Ⅰ有催化加速作用;反应Ⅰ速率远大于反应Ⅱ,近似认为反应Ⅰ建立平衡后始终处于平衡状态。忽略水的电离,其浓度视为常数。
回答下列问题:
(1)一定条件下,反应Ⅰ,Ⅱ的焓变分别为ΔH1、ΔH2,则该条件下水气变换反应的焓变ΔH=ΔH2-ΔH1ΔH2-ΔH1(用含ΔH1、ΔH2的代数式表示)。
(2)反应Ⅰ正反应速率方程为:v=kc(H+ )•c(HCOOH),k为反应速率常数。T1温度下,HCOOH电离平衡常数为Ka,当HCOOH平衡浓度为xmol•L-1时,H+浓度为 x•Kax•Kamol•L-1,此时反应Ⅰ正反应速率v=x×K×x•Kax×K×x•Kamol•L-1•h-1(用含Ka、x和k的代数式表示)。
(3)T3温度下,在密封石英管内完全充满1.0mol•L-1HCOOH水溶液,使HCOOH分解,分解产物均完全溶于水。含碳物种浓度与反应时间的变化关系如图所示(忽略碳元素的其他存在形式)。t1时刻测得CO、CO2的浓度分别为0.70mol•L-1、0.16mol•L-1,反应Ⅱ达平衡时,测得H2的浓度为ymol•L-1。体系达平衡后,c(CO)c(CO2)=5-5y6y5-5y6y(用含y的代数式表示,下同),反应Ⅱ的平衡常数为 6y21-y6y21-y。
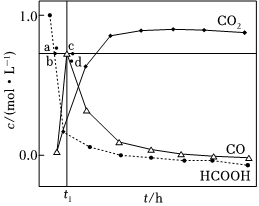
相同条件下,若反应起始时溶液中同时还含有0.10mol•L-1盐酸,则图示点a、b、c、d中,CO新的浓度峰值点可能是 aa(填标号)。与不含盐酸相比,CO达浓度峰值时,CO2浓度 减小减小(填“增大”“减小”或”不变”),c(CO)c(HCOOH)的值 不变不变(填“增大”“减小”或“不变”)。
x
•
K
a
x
•
K
a
x
•
K
a
x
•
K
a
c
(
CO
)
c
(
C
O
2
)
5
-
5
y
6
y
5
-
5
y
6
y
6
y
2
1
-
y
6
y
2
1
-
y
c
(
CO
)
c
(
HCOOH
)
【答案】ΔH2-ΔH1;;x×K×;;;a;减小;不变
x
•
K
a
x
•
K
a
5
-
5
y
6
y
6
y
2
1
-
y
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/5/8 8:0:8组卷:661引用:5难度:0.5
相关试卷