硝酸在生产生活及国防建设中非常重要,工业制备硝酸的流程如图:
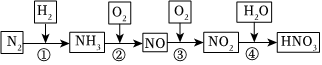
(1)②反应的化学方程式为 4NH3+5O2催化剂△4NO+6H2O4NH3+5O2催化剂△4NO+6H2O,④反应中还原剂和氧化剂的物质的量之比为 2:12:1。
(2)Cu与稀硝酸反应的离子方程式为 3Cu+8H++2NO-3=3Cu2++2NO↑+4H2O3Cu+8H++2NO-3=3Cu2++2NO↑+4H2O。
(3)硝酸工厂产生的氮氧化物的尾气需处理后才能排放,可用NaOH溶液吸收。主要反应为NO+NO2+2OH-=2NO-2+H2O,2NO2+2OH-=NO-2+NO-3+H2O。下列措施能提高NO和NO2去除率的有 BCBC(填字母)。
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
(4)也可用Na2CO3溶液吸收氮氧化物的尾气制备NaNO2、NaNO3。工艺流程如图:
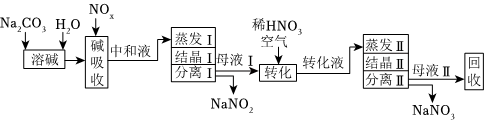
已知:Na2CO3+NO+NO2=2NaNO2+CO2。
①母液Ⅰ进行转化时通入空气的目的是 将NaNO2氧化为NaNO3将NaNO2氧化为NaNO3。母液Ⅱ需回收利用,合理的处理方法是转入流程中 转化液转化液中(填“中和液”或“转化液”)。
②若将NaNO2、NaNO3两种产品的物质的量之比设为1:1,则生产69tNaNO2时,Na2CO3的理论用量为 106106t(假定Na2CO3恰好完全反应)。
催化剂
△
催化剂
△
NO
-
3
NO
-
3
NO
-
2
NO
-
2
NO
-
3
【答案】4NH3+5O24NO+6H2O;2:1;3Cu+8H++2=3Cu2++2NO↑+4H2O;BC;将NaNO2氧化为NaNO3;转化液;106
催化剂
△
NO
-
3
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/8/8 8:0:9组卷:75引用:2难度:0.6
相似题
-
1.硝酸是重要的化工产品,硝酸的工业制法包括氨气的催化氧化等步骤。模仿硝酸的工业制备过程,在实验室通过简单的装置可制备硝酸。以下为实验室制备硝酸的流程图(已知三氧化二铬用作催化剂,干燥剂2为浓硫酸):

(1)下面哪套装置可以代替流程图中①和②的作用
(2)①中浓氨水可挥发出氨气,实验室检验氨气的方法是。(要求写出操作、现象与结论)
(3)③中发生的化学反应是氨气的催化氧化,写出反应方程式。
(4)反应一段时间后,观察到③中物质呈红热状态;停止加热后仍能保持红热,该反应是反应(填“吸热”或“放热”)。
(5)通过红热的三氧化二铬后反应后的气体仍然是混合气体,其成分除了空气外,还有。
(6)盛有Na2CO3溶液的烧杯为尾气处理装置,该装置中反应的化学反应方程式是NO2+Na2CO3═NaNO2+CO2+□(请在横线上补充另外一种产物并在横线内配平出相关系数,系数为1也要标出)发布:2024/11/2 8:0:1组卷:72引用:1难度:0.9 -
2.氮元素的化合物种类繁多,请结合以下工业制硝酸的原理示意图,判断下列说法不正确的是( )
 发布:2024/12/4 23:30:1组卷:55引用:1难度:0.6
发布:2024/12/4 23:30:1组卷:55引用:1难度:0.6 -
3.硝酸铵是一种常用的化肥,其工业生产流程如图,请回答下列问题。

(1)写出反应容器B中发生反应的化学方程式:。
(2)吸收塔C中通入空气的目的是(用化学方程式解释);C、D两个反应容器中发生的反应,属于氧化还原反应的是(填反应容器代号)。
(3)浓硝酸一般保存在棕色试剂瓶里,并放置在阴凉处,用化学方程式解释原因:。
(4)碳与浓硝酸反应的化学方程式是。发布:2024/11/5 8:0:2组卷:26引用:2难度:0.9


