长郡中学化学社同学为研究氯气制备和氯水的成分及性质进行了如下实验。
【实验1】制备氯气。如图是实验室制取纯净,干燥氯气的装置图。
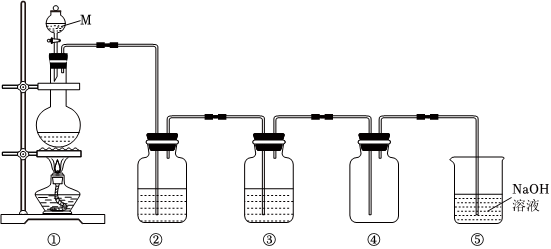
(1)M仪器的名称是 分液漏斗分液漏斗,①中反应的离子方程式是 MnO2+2Cl-+4H+ △ Cl2↑+Mn2++2H2OMnO2+2Cl-+4H+ △ Cl2↑+Mn2++2H2O。
(2)②中盛放的试剂是 饱和食盐水饱和食盐水。
(3)⑤中反应的离子方程式是 Cl2+2OH-=Cl-+ClO-+H2OCl2+2OH-=Cl-+ClO-+H2O。
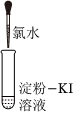
【实验2】研究氯水性质。实验操作及现象如下表。
资料:淀粉的特征反应——遇变蓝色
M
n
O
2
+
2
C
l
-
+
4
H
+
△
C
l
2
↑
+
M
n
2
+
+
2
H
2
O
M
n
O
2
+
2
C
l
-
+
4
H
+
△
C
l
2
↑
+
M
n
2
+
+
2
H
2
O
C
l
2
+
2
O
H
-
=
C
l
-
+
C
l
O
-
+
H
2
O
C
l
2
+
2
O
H
-
=
C
l
-
+
C
l
O
-
+
H
2
O
| 实验2-1 | 实验2-2 | |
| 实验操作 (氯水均为新制) |
 |
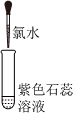 |
| 实验现象 | 溶液变蓝 | 石蕊溶液先变红,后褪色 |
Cl2+2KI=I2+2KCl
Cl2+2KI=I2+2KCl
,由此推断氧化性:Cl2>
>
I2(填“>”或“<”)。②实验2-2中使溶液褪色的微粒是
HClO
HClO
。③证明氯水中含有氯离子的方案是
取少量氯水于一支洁净试管中,加入过量稀硝酸使其酸化,再滴入AgNO3溶液,若产生白色沉淀,则含有Cl-,反之则无
取少量氯水于一支洁净试管中,加入过量稀硝酸使其酸化,再滴入AgNO3溶液,若产生白色沉淀,则含有Cl-,反之则无
。【答案】分液漏斗; ;饱和食盐水;;Cl2+2KI=I2+2KCl;>;HClO;取少量氯水于一支洁净试管中,加入过量稀硝酸使其酸化,再滴入AgNO3溶液,若产生白色沉淀,则含有Cl-,反之则无
M
n
O
2
+
2
C
l
-
+
4
H
+
△
C
l
2
↑
+
M
n
2
+
+
2
H
2
O
C
l
2
+
2
O
H
-
=
C
l
-
+
C
l
O
-
+
H
2
O
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/10/14 9:0:2组卷:33引用:2难度:0.7
相似题
-
1.为了验证干燥的氯气无漂白性,湿润的氯气具有漂白性,某同学设计实验如图.其中B、C、D、E、F分别盛有饱和食盐水、浓硫酸.干燥红色布条、浓硫酸、湿润红色布条.
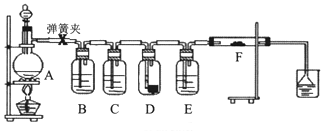
请回答:
(1)E中浓硫酸的作用.
(2)将F中的湿润布条换成卷曲的细铜丝,并用酒精灯加热,可看到的现象是.
(3)若用装置A制取2.24L(标况)氯气,消耗10mol/L浓盐酸的体积明显大于40mL,造成该结果的可能原因有.
A.浓盐酸的挥发 B.随反应进行盐酸浓度下降
C.加热时火力不够猛 D.MnO2固体过量.发布:2025/1/15 8:0:2组卷:17引用:1难度:0.3 -
2.如图是某同学设计的氯气制备及性质验证实验装置。相关说法正确的是( )
 发布:2025/1/15 8:0:2组卷:20引用:2难度:0.8
发布:2025/1/15 8:0:2组卷:20引用:2难度:0.8 -
3.实验室中模拟用甲烷与氯气反应得到的副产品来制取盐酸,原理如图,下列说法不正确的是( )
 发布:2024/12/30 17:0:5组卷:61引用:1难度:0.7
发布:2024/12/30 17:0:5组卷:61引用:1难度:0.7


