某化学兴趣小组同学利用以下装置制取Cl2并探究红色纸条褪色的原因(Ⅳ中夹持装置已略去,a为干燥的红色纸条,b为湿润的红色纸条)。
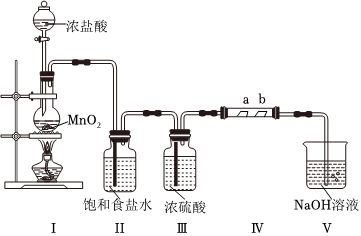
(1)装置Ⅰ可用于制取Cl2,写出该反应的化学方程式 MnO2+4HCl(浓) △ MnCl2+Cl2↑+2H2OMnO2+4HCl(浓) △ MnCl2+Cl2↑+2H2O。
(2)装置Ⅱ的作用是 除去氯气中的HCl除去氯气中的HCl。
(3)装置Ⅳ中a处红色纸条无明显变化,b处红色纸条褪色,同学猜测使b处红色纸条褪色的物质是 HClOHClO。
(4)该小组同学查阅资料,发现:
①NaClO溶液具有氧化性,能使红色纸条褪色
②溶液的pH会影响NaClO溶液的漂白效果
该小组同学利用市售“84”消毒液(主要成分:NaClO)探究不同pH下红色纸条褪色的情况,实验如下:
△
△
| 实验方案 | 实验现象 | |
| 1.将市售“84”消毒液稀释至溶液的pH=12。 2.取20mLpH=12的稀释液各3份,分别用H2SO4溶液将pH调至10、7和4(溶液体积变化忽略不计)。 3.分别放入大小相同的红色纸条。 |
pH=10 | 10min后,红色纸条基本不褪色;4h后红色褪去。 |
| pH=7 | 10min后,红色纸条颜色变浅;4h后红色褪去。 | |
| pH=4 | 10min后,红色纸条颜色变得更浅;4h后红色褪去。 | |
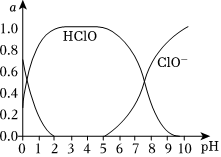
①由实验现象可知:溶液的pH在4~10范围内,pH越大,红纸褪色
越慢
越慢
。②结合图像分析pH=7和pH=4的溶液,现象差异的原因
pH=4的稀释液中HClO的质量分数大于pH=7的稀释液,所以pH=4的稀释液反应速率较快,红色纸条褪色较快
pH=4的稀释液中HClO的质量分数大于pH=7的稀释液,所以pH=4的稀释液反应速率较快,红色纸条褪色较快
。③结合实验现象和图像可知,氧化性:HClO
>
>
NaClO(填“>”或“<”)。“84”消毒液主要成分是NaClO而不是HClO,因为HClO不稳定,不易保存。写出HClO见光分解的化学方程式 2HClO 2HCl+O2↑
光照
2HClO 2HCl+O2↑
。光照
综上所述,HClO能使红色纸条褪色,“84”消毒液在酸性环境下漂白效果更佳。
【答案】MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O;除去氯气中的HCl;HClO;越慢;pH=4的稀释液中HClO的质量分数大于pH=7的稀释液,所以pH=4的稀释液反应速率较快,红色纸条褪色较快;>;2HClO 2HCl+O2↑
△
光照
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/10/18 3:0:2组卷:4引用:1难度:0.6
相似题
-
1.为了验证干燥的氯气无漂白性,湿润的氯气具有漂白性,某同学设计实验如图.其中B、C、D、E、F分别盛有饱和食盐水、浓硫酸.干燥红色布条、浓硫酸、湿润红色布条.
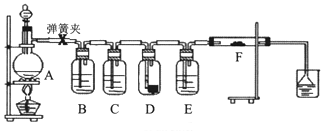
请回答:
(1)E中浓硫酸的作用.
(2)将F中的湿润布条换成卷曲的细铜丝,并用酒精灯加热,可看到的现象是.
(3)若用装置A制取2.24L(标况)氯气,消耗10mol/L浓盐酸的体积明显大于40mL,造成该结果的可能原因有.
A.浓盐酸的挥发 B.随反应进行盐酸浓度下降
C.加热时火力不够猛 D.MnO2固体过量.发布:2025/1/15 8:0:2组卷:17引用:1难度:0.3 -
2.如图是某同学设计的氯气制备及性质验证实验装置。相关说法正确的是( )
 发布:2025/1/15 8:0:2组卷:20引用:2难度:0.8
发布:2025/1/15 8:0:2组卷:20引用:2难度:0.8 -
3.实验室中模拟用甲烷与氯气反应得到的副产品来制取盐酸,原理如图,下列说法不正确的是( )
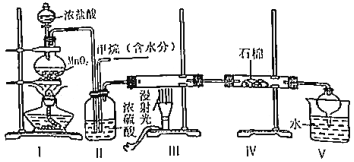 发布:2024/12/30 17:0:5组卷:61引用:1难度:0.7
发布:2024/12/30 17:0:5组卷:61引用:1难度:0.7


