同学们在学习完氧气的性质后,知道了“氧气能使带火星的木条复燃”,在此基础上,同学们提出了以下问题,并逐一进行了探究。
(1)【问题一】带火星的木条复燃能否证明氧气是纯氧?
【进行实验】同学们用数字化实验探测仪进行实验(如图),并获得了一系列数据。
| 集气瓶编号 | ① | ② | ③ | ④ | ⑤ |
| 氧气浓度(体积分数) | 25% | 35% | ... | 55% | 65% |
| 带火星木条情况 | 微亮 | 亮 | 很亮 | 复燃 | 复燃 |

【收集证据】③号集气瓶内的氧气浓度可能是
45%
45%
。【实验结论】
带火星的木条复燃不能证明氧气是纯氧
带火星的木条复燃不能证明氧气是纯氧
。【反思与评价】分析以上数据可知欲收集一瓶较为纯净的氧气最好的收集方法是
排水法
排水法
。(2)【问题二】铁丝在氧气中的燃烧与氧气浓度和铁丝粗细有关系吗?
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| 氧气浓度(体积分数) | 34% | 47% | 60% | 73% | 86% |
| 直径0.2mm的细铁丝 | 不燃烧 | 稍有燃烧 | 剧烈燃烧 | 剧烈燃烧 | 剧烈燃烧 |
| 直径0.5mm的粗铁丝 | 不燃烧 | 不燃烧 | 不燃烧 | 稍有燃烧 | 剧烈燃烧 |
剧烈燃烧,火星四射,放出热量,生成黑色固体
剧烈燃烧,火星四射,放出热量,生成黑色固体
。【实验解释】有关反应的文字表达式是
铁+氧气四氧化三铁
点燃
铁+氧气四氧化三铁
,实验操作中,在集气瓶底部放少量水或 点燃
细沙
细沙
,目的是 防止炽热生成物溅落下来,炸裂瓶底
防止炽热生成物溅落下来,炸裂瓶底
。【实验结论】在相同条件下,氧气浓度越
大
大
,铁丝燃烧越剧烈。铁丝越细,燃烧越 剧烈
剧烈
。【表达与交流】在完成铁丝燃烧的实验时,为保证实验成功需注意的一项实验操作是
除去铁锈
除去铁锈
。【拓展延伸】已知铁原子质量为m克,碳-12原子质量为n克,求铁原子的相对原子质量?(列式即可)
【考点】探究氧气的性质.
【答案】45%;带火星的木条复燃不能证明氧气是纯氧;排水法;剧烈燃烧,火星四射,放出热量,生成黑色固体;铁+氧气四氧化三铁;细沙;防止炽热生成物溅落下来,炸裂瓶底;大;剧烈;除去铁锈
点燃
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/9/21 21:0:9组卷:108引用:2难度:0.5
相似题
-
1.某化学兴趣小组在做“铁丝在氧气里燃烧”实验时,进行了一系列探究活动。
探究一:铁丝燃烧是否需要纯氧
【实验内容】取0.38mm的铁丝,分别在体积分数为90%、70%、60%、55%的氧气中实验。
【讨论】
(1)空气中氧气的含量按20%计,用集气瓶收集含氧气60%的气体的方法可以是:。
【实验】
【结论】O2% 90% 70% 60% 55% 实验现象 燃烧剧烈、燃烧时间长,效果好 燃烧比90%弱,燃烧时间短,实验成功 燃烧比70%弱,燃烧时间更短,实验成功 难以燃烧只是发红
(2)就0.38mm铁丝而言,燃烧所需氧气的最低体积分数为,且氧气浓度越大,燃烧现象越(填“剧烈”或“不剧烈”)。
探究二:铁丝燃烧产生火星四射的原因
(3)图中螺旋状铁丝的末端系一根火柴的作用是。
(4)对铁丝在氧气中燃烧为什么会火星四射进行探究。下表是将纯铁丝和不同含碳量的铁丝(铁丝直径为0.4mm)放入氧气中燃烧时的实验现象的记录。请分析完成下表:
通过以上实验,说明铁丝燃烧产生火星四射现象和物质 纯铁丝 含碳0.05%的铁丝 含碳0.2%的铁丝 含碳0.6%的铁丝 燃烧时的现象 无火星四射现象,熔断 剧烈燃烧,极少火星 剧烈燃烧,少量火星 (填元素符号)有关。发布:2024/10/13 12:0:2组卷:42引用:2难度:0.5 -
2.小明对铁丝在氧气中燃烧为什么会火星四射进行探究。下表是他纯镁条和不同含碳量的铁丝(镁条和铁丝直径均为0.4mm)放入氧气中燃烧时的实验现象的记录。请你分析回答:
(1)表中“A”处内容应为物质 镁条 含碳0.05%的铁丝 含碳0.2%的铁丝 含碳0.6%的铁丝 燃烧时的现象 剧烈燃烧,
无火星。剧烈燃烧
极少火星剧烈燃烧
少量火星A 。
(2)镁条燃烧的化学式表达式为。
(3)通过以上探究,你认为铁丝燃烧产生火星四射现象的原因可能是;实验时,铁丝需绕成螺旋状的目的是,为防止瓶底炸裂,需,铁丝燃烧的化学式表达式为。
(4)铁除了可以在氧气中燃烧,还可以在空气中发生缓慢氧化,该过程(填“放热”或“吸热”);在生活中缓慢氧化的例子很多,下列也属于缓慢氧化的是(填序号)。
①锅炉爆炸 ②动植物的呼吸 ③食物的腐烂 ④水结成冰 ⑤酒和醋的酿造 ⑥农家肥的腐熟 ⑦火药爆炸
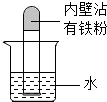
(5)某同学利用铁粉来测定空气中氧气的含量,如图所示,将足量的铁粉用水均匀地粘在试管内壁上,将试管倒立在装有水的烧杯中。实验过程中,观察到试管内液面缓慢上升。下列分析错误的是
A.水能进入试管的最大体积为试管容积的1/5
B.该铁粉在试管内发生了氧化反应
C.这一实验可以验证空气的组成不是单一的
D.如果把铁粉改为木炭粉,两者的现象完全相同发布:2024/11/4 8:0:2组卷:22引用:1难度:0.5 -
 3.做完“铁在氧气里燃烧”实验后,某兴趣小组有一些疑惑不解的问题,于是他们进行了以下探究活动,请你一同参与。
3.做完“铁在氧气里燃烧”实验后,某兴趣小组有一些疑惑不解的问题,于是他们进行了以下探究活动,请你一同参与。
【问题】细铁丝在氧气中燃烧为什么会“火星四射”?
【查阅资料1】①日常生活中的钢铁制品都含有少量碳杂质。
②含碳细铁丝燃烧时,其中的炭粒生成的CO2气体在熔融液态物质中形成气泡,熔融液态物质因气泡炸裂引起“火星四射”的现象。
(1)(设计实验)为了探究细铁丝在纯氧中燃烧产生“火星四射”现象的原因,该小组同学设计的实验方案是:取长短粗细相同的含碳细铁丝和不含碳的细铁丝,分别在足量的氧气中燃烧,观察现象。你认为他们的方案(填“合理”或“不合理”)。
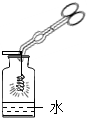
(2)(实验探究)小明做细铁丝在氧气中的燃烧实验时,他把细铁丝绕成螺旋状,一端系在一根铁丝上,另一端系上一根火柴。点燃火柴后迅速把铁丝连同火柴一起插入集气瓶下部(没有接触到水,如图所示),但不见铁丝燃烧,反复实验均未成功。
该同学认为可能导致失败的原因主要有三种:
A.铁丝表面有锈迹,影响了反应的进行;
B.点燃火柴后立即将它伸入瓶内,火柴燃烧消耗了氧气,不利于铁丝的燃烧;
C.火柴燃烧时有大量的热量放出,将铁丝和火柴迅速伸至集气瓶下部,因热胀冷缩之故。瓶内氧气会膨胀逸出,使铁丝无法燃烧。
针对假设A应作出的实验改进为;
针对假设B应作出的实验改进为;
针对假设C应作出的实验改进为。
(3)【查阅资料2】①黑色的Fe3O4和红色的Fe2O3的分解温度、铁的熔点见下表:
②Fe2O3高温时分解成Fe3O4
③FeO不稳定,容易被空气中的氧气氧化成Fe2O3
(理论探讨)根据铁丝燃烧的实验现象,并结合表中数据,可推知铁在氧气里燃烧时产生的高温应在Fe3O4 Fe2O3 铁 分解温度℃ 1538 1400 — 熔点/℃ — — 1535 之间,在此温度范围内Fe2O3已分解,所以铁在氧气里燃烧的产物是Fe3O4,其化学反应方程式。
(4)[拓展延伸]有些超市的食品密封包装盒的透明盖内放有黑色的FeO粉末,若粉末的颜色,就说明包装盒破损进气,这样售货员就能及时发现并处理。发布:2024/10/16 5:0:1组卷:52引用:1难度:0.5


