历史上纯碱工业的发展经历了三个重要阶段,
Ⅰ.第一阶段是路布兰制碱法,流程如图:
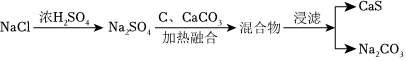
(1)写出CaS的电子式 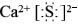
 。
。
(2)“加热融合”过程中还会产生CO,写出该反应的化学方程式 CaCO3+Na2SO4+4C 高温 CaS+Na2CO3+4CO↑CaCO3+Na2SO4+4C 高温 CaS+Na2CO3+4CO↑。
Ⅱ.第二和第三阶段分别是索尔维制碱法和侯氏制碱法,两种工艺的差异之一在于对“滤液”的处理方法不同,流程如图:
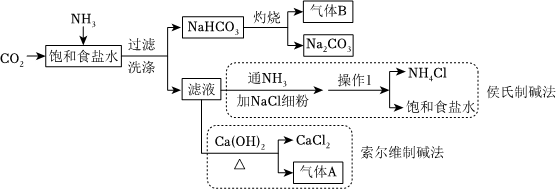
(3)向“饱和食盐水”中先通入 NH3NH3(填“CO2”或“NH3”),再通入另一种气体,可析出NaHCO3固体,该反应的化学方程式为 NaCl+CO2+NH3+H2O═NaHCO3↓+NH4ClNaCl+CO2+NH3+H2O═NaHCO3↓+NH4Cl。
(4)索尔维制碱法中能够循环利用的物质有 NH3、CO2NH3、CO2(填化学式)。
(5)已知:NaCl和NH4Cl在不同温度时的溶解度如下表所示,“操作Ⅰ”为 降温结晶降温结晶、过滤。
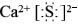
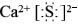
高温
高温
| 温度/℃ 溶解度/g 物质 |
0 | 20 | 40 | 60 | 80 |
| NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 |
| NH4Cl | 29.4 | 37.2 | 45.8 | 55.2 | 65.6 |
将纯碱样品溶于水,加入足量稀硝酸酸化,再滴加AgNO3溶液,生成白色沉淀
将纯碱样品溶于水,加入足量稀硝酸酸化,再滴加AgNO3溶液,生成白色沉淀
。(7)纯碱用途广泛,写出其中一种用途
作洗涤剂
作洗涤剂
。(8)对比索尔维制碱法,侯氏制碱法的优点是
产生的氯化铵可作肥料(或NaCl的利用率高)
产生的氯化铵可作肥料(或NaCl的利用率高)
(写出一条即可)。【考点】纯碱工业(侯氏制碱法).
【答案】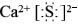 ;CaCO3+Na2SO4+4C CaS+Na2CO3+4CO↑;NH3;NaCl+CO2+NH3+H2O═NaHCO3↓+NH4Cl;NH3、CO2;降温结晶;将纯碱样品溶于水,加入足量稀硝酸酸化,再滴加AgNO3溶液,生成白色沉淀;作洗涤剂;产生的氯化铵可作肥料(或NaCl的利用率高)
;CaCO3+Na2SO4+4C CaS+Na2CO3+4CO↑;NH3;NaCl+CO2+NH3+H2O═NaHCO3↓+NH4Cl;NH3、CO2;降温结晶;将纯碱样品溶于水,加入足量稀硝酸酸化,再滴加AgNO3溶液,生成白色沉淀;作洗涤剂;产生的氯化铵可作肥料(或NaCl的利用率高)
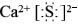 ;CaCO3+Na2SO4+4C
;CaCO3+Na2SO4+4C高温
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/6/17 8:0:9组卷:120引用:2难度:0.5
相似题
-
1.以NaCl为原料,可制取纯碱。Na2CO3可用侯氏制碱法制取,主要涉及如下反应:NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl;2NaHCO3
Na2CO3+CO2↑+H2O,下列有关实验室模拟侯氏制碱法的实验原理和装置正确的是( )△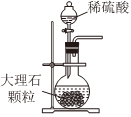
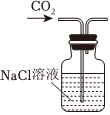
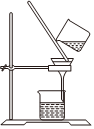
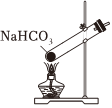
A.制取CO2 B.制取NaHCO3 C.分离NaHCO3 D.制取Na2CO3 发布:2024/12/8 18:0:1组卷:170引用:5难度:0.8 -
2.“侯氏制碱法”的主要过程如图(部分物质已略去)。
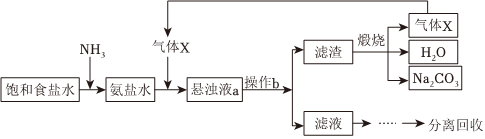
下列说法错误的是( )发布:2024/12/8 0:0:1组卷:135引用:4难度:0.7 -
3.氨碱法(索氏)和联合制碱法(侯氏)是两大重要的工业制碱法,下列表达正确的是( )
氨碱法 联合制碱法 A 原料 食盐、氨气、生石灰 食盐、氨气、二氧化碳 B 副产物 氯化钙 氯化铵 C 循环物质 氨气、二氧化碳 氯化钠 D 评价 原料易得、设备简单、能耗低 原料利用率高、废弃物少 发布:2024/12/16 6:0:1组卷:38引用:2难度:0.8


