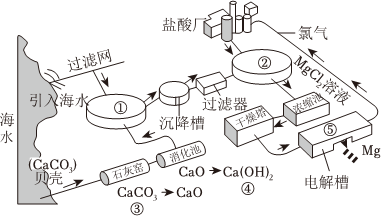
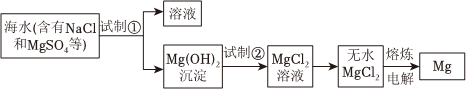
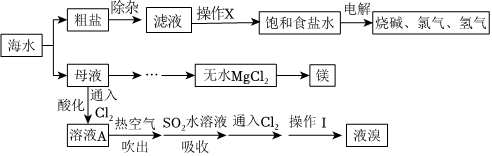
海洋是一个巨大的化学资源宝库。海水资源综合利用的部分过程如图所示。
回答下列问题:
(1)粗盐中含有SO2-4、Mg2+、Ca2+等可溶性杂质。根据除杂原理,在表中填写“除杂”时依次添加的试剂及其预期沉淀的离子。
SO
2
-
4
| 实验步骤 | 试剂 | 预期沉淀的离子 |
| 步骤1 | BaCl2溶液 | SO 2 - 4 |
| 步骤2 |
NaOH溶液 NaOH溶液
|
Mg2+ Mg2+
|
| 步骤3 |
Na2CO3溶液 Na2CO3溶液
|
Ba2+和Ca2+ Ba2+和Ca2+
|
蒸发浓缩
蒸发浓缩
。(3)镁可从母液中提取。工业上由无水MgCl2制取Mg的化学方程式为
MgCl2(熔融) Mg+Cl2↑
电解
MgCl2(熔融) Mg+Cl2↑
。电解
(4)海水提溴工艺流程主要包括氧化、吹出、吸收、分离等环节。
①向母液中通入适量的Cl2,其目的是
2Br-+Cl2=Br2+2Cl-
2Br-+Cl2=Br2+2Cl-
(用离子方程式表示)。②已知溴的沸点为59℃,上述流程中“操作Ⅰ”应为
蒸馏
蒸馏
。(5)下列有关说法正确的是
BD
BD
。A海水中含量最多的元素是Na、Cl
B.海水淡化的主要方法有蒸馏法、电渗析法和离子交换法
C.电解饱和食盐水过程中既发生氧化反应又发生还原反应
D.海水提溴工艺中“吹出”和“吸收”两环节的目的是富集溴
【考点】海水资源及其综合利用;海水淡化.
【答案】NaOH溶液;Mg2+;Na2CO3溶液;Ba2+和Ca2+;蒸发浓缩;MgCl2(熔融) Mg+Cl2↑;2Br-+Cl2=Br2+2Cl-;蒸馏;BD
电解
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/9/2 1:0:8组卷:26引用:1难度:0.5