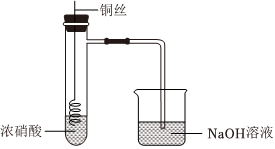
 铜(过量)与浓硝酸反应,制备少量NaNO3,装置如图所示。
铜(过量)与浓硝酸反应,制备少量NaNO3,装置如图所示。
资料:H++NO-2=HNO2,HNO2不稳定,易分解为硝酸和一氧化氮。
(1)产生的红棕色气体是 NO2NO2。
(2)一段时间后,试管中不再产生气体,静置。
①试管中溶液c(H+) <<c(NO-3)(填“>”或“<”)。
②滴加稀H2SO4,铜丝继续溶解,产生无色气体,反应的离子方程式是 3Cu+8H++2NO-3=3Cu2++2NO↑+4H2O3Cu+8H++2NO-3=3Cu2++2NO↑+4H2O。
(3)NaOH溶液吸收NO2、NO。
①2NO2+2NaOH=NaNO2+H2O+NaNO3NaNO3。
②NO+NO2+2NaOH=2NaNO2+H2O。
(4)向烧杯中加入稀HNO3,加热,搅拌,冷却结晶,过滤得NaNO3固体。稀HNO3的作用是HNO3+NaOH=NaNO3+H2O、3NaNO2+2HNO3═3NaNO3+2NO↑+H2O3NaNO2+2HNO3═3NaNO3+2NO↑+H2O(用化学方程式表示)。
NO
-
2
NO
-
3
NO
-
3
NO
-
3
【考点】硝酸的化学性质.
【答案】NO2;<;3Cu+8H++2=3Cu2++2NO↑+4H2O;NaNO3;3NaNO2+2HNO3═3NaNO3+2NO↑+H2O
NO
-
3
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/7/24 8:0:9组卷:75引用:1难度:0.8


