反应Zn+H2SO4=ZnSO4+H2↑的能量变化趋势如图甲所示。
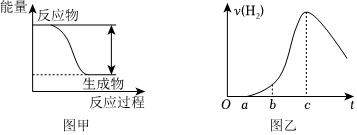
(1)该反应为 放热放热(填“吸热”或“放热”)反应。
(2)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为 正正(填“正”或“负”)极。铜片上产生的现象为 冒气泡冒气泡,该极的电极反应式为 2H++2e-=H2↑2H++2e-=H2↑。
(3)某学生为了探究锌与硫酸反应过程中的速率变化,将表面被氧化的锌粒投入稀硫酸中,测得生成氢气的速率v(H2)与反应时间t关系曲线如图乙所示。
①曲线0~a段,反应的离子方程是为 ZnO+2H+=Zn2++H2OZnO+2H+=Zn2++H2O。
②曲线b~c段,产生氢气的速率增加较快的主要原因是 反应放热,溶液温度升高反应放热,溶液温度升高。
③曲线由c以后,产生氢气的速率逐渐下降的主要原因是 溶液中的氢离子浓度逐渐降低溶液中的氢离子浓度逐渐降低。
【答案】放热;正;冒气泡;2H++2e-=H2↑;ZnO+2H+=Zn2++H2O;反应放热,溶液温度升高;溶液中的氢离子浓度逐渐降低
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/7/8 8:0:10组卷:55引用:1难度:0.7



