空气中氧气含量测定的再认识,
Ⅰ.用红磷测定空气中氧气的含量。
(1)请写出红磷在空气中燃烧的化学方程式为 4P+5O2 点燃 2P2O54P+5O2 点燃 2P2O5。
(2)如图1实验,测得空气中氧气体积分数小于五分之一,可能的原因是 BDBD。(填序号)

A.燃烧匙伸入集气瓶太慢B.红磷量不足
C.实验中发现导管口有气泡冒出D.装置漏气
Ⅱ.用镁条测定空气中氧气的含量。
(3)某同学利用图2实验测定空气中氧气含量时发现,产物中还出现少许黄色固体。
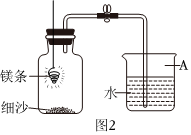
已知:镁能与氮气反应生成液黄色的氮化镁(Mg3N2)固体,但在空气中燃烧镁条时很难观察到生成物中有淡黄色固体,原因是 氮气化学性质不活泼,在空气中燃烧镁条时只有极少量的镁与氮气发生了反应氮气化学性质不活泼,在空气中燃烧镁条时只有极少量的镁与氮气发生了反应。反应的方程式为 3Mg+N2 点燃 Mg3N23Mg+N2 点燃 Mg3N2。若要生成2g氮化镁,则参加反应镁的质量为 1.44g1.44g。在操作规范的情况下,该同学实验所测得的氧气体积分数 大于大于五分之一(填“大于”、“小于”或“等于”)。
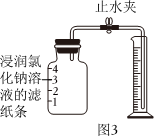
Ⅲ.用铁粉测定空气中氧气的含量,
(4)已知铁在常温下与空气中氧气和水反应生成铁锈,某同学根据铁生锈的原理,用铁粉测定空气中氧气的含量,设计了如图3实验,实验时该同学不是将铁粉堆积在瓶底而是将铁粉撒在浸润了氯化钠溶液的滤纸条上,再将该滤纸条贴在集气瓶内侧,8分钟后测得数据如表:
点燃
点燃
点燃
点燃
| 实验前的体积 | 实验后的体积 | |
| 集气瓶内空气 | 量筒内水 | 量筒内剩余水 |
| 250mL | 180.0mL | 128.0mL |
20.8%
20.8%
,与用红磷燃烧的方法相比,用该方法测定空气中氧气的含量的主要优点:一是 实验结果更准确
实验结果更准确
。二是 更环保
更环保
。Ⅳ.完成下列问题
(5)图1为利用气压传感器测定红磷燃烧时集气瓶内气压变化的实验装置。点燃燃烧匙内的红磷后,立即伸入集气瓶中并把塞子塞紧,待红磷熄灭并冷却后,打开止水夹,集气瓶内气压的变化情况如图2,下列说法正确的是
ABC
ABC
。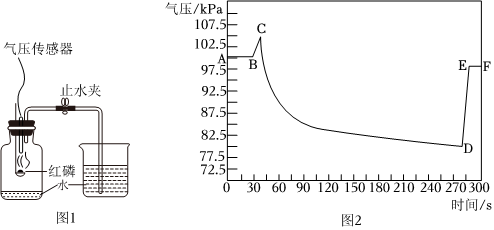
A.BC段气压增大的主要原因是红磷燃烧放出热量
B.CD段气压减小的主要原因是集气瓶内温度降低和氧气被消耗
C.DE段气压增大的主要原因是烧杯中的水进入集气瓶
D.若用硫磺代替红磷完成此实验,集气瓶内气压变化趋势与图2基本一致
【考点】测定空气里氧气含量的探究.
【答案】4P+5O2 2P2O5;BD;氮气化学性质不活泼,在空气中燃烧镁条时只有极少量的镁与氮气发生了反应;3Mg+N2 Mg3N2;1.44g;大于;20.8%;实验结果更准确;更环保;ABC
点燃
点燃
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/10/21 6:0:2组卷:48引用:2难度:0.5
相似题
-
1.如图1是某化学兴趣小组利用气压传感器测定红磷燃烧时集气瓶内气压变化的实验装置。图2是集气瓶内气压随时间的变化情况。下列说法不正确的是( )
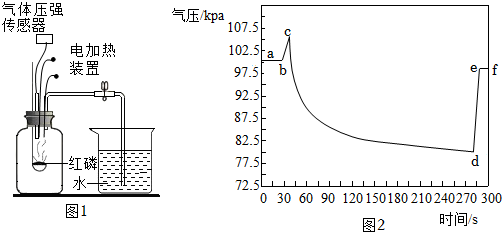 发布:2024/12/25 11:30:2组卷:1085引用:3难度:0.7
发布:2024/12/25 11:30:2组卷:1085引用:3难度:0.7 -
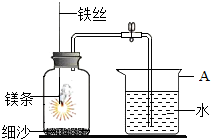 2.某校研究性学习小组用如图所示装置进行镁条在空气中燃烧的实验。待镁条完全燃烧并冷却后打开弹簧夹,进入集气瓶中水的体积约占集气瓶容积的70%。
2.某校研究性学习小组用如图所示装置进行镁条在空气中燃烧的实验。待镁条完全燃烧并冷却后打开弹簧夹,进入集气瓶中水的体积约占集气瓶容积的70%。
(1)图中A仪器的名称是。镁条燃烧并冷却后打开弹簧夹,水能进入到集气瓶中的原因是。
(2)如果镁条只和空气中的氧气反应,则进入集气瓶中水的体积最多不超过其容积的%.现进入集气瓶中水的体积约为其容积的70%,根据空气的组成可推出减少的气体中有氮气。
【发现问题】氮气是如何减少的?
【做出猜想】。
【查阅资料】镁条在氮气中能燃烧,产物为氮化镁(Mg3N2)固体。氮化化镁中氮的化合价是。镁条还可以在二氧化碳气体中燃烧生成碳和氧化镁,反应的化学方程式为2Mg+CO2C+2MgO,该反应所的基本反应类型是点燃。
(3)通过以上探究,你对燃烧的有关知识有了哪些新的认识?(写出一条即可)
(4)24g镁在二氧化碳中燃烧可生成多少克氧化镁?发布:2024/11/18 8:0:1组卷:13引用:1难度:0.5 -
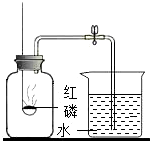 3.测定空气里氧气的含量,甲、乙、丙三个同学用如图所示的装置分别进行了实验探究。
3.测定空气里氧气的含量,甲、乙、丙三个同学用如图所示的装置分别进行了实验探究。
(1)实验时,取下橡胶塞,点燃红磷后迅速伸入集气瓶中并旋紧橡胶塞,这时看到的现象是,该反应的文字表达式为。
(2)甲同学:用足量的木炭代替红磷做测定空气中氧气含量的实验,结果实验失败了,请你帮助他分析失败的原因:。
(3)乙同学:想用镁条来代替红磷做实验,老师告诉他这种方法不是较好的方法,因为镁条在空气中燃烧非常剧烈,镁既可以和氧气反应,也可以和氮气反应生成氮化镁。请写出镁和氮气反应生成氮化镁的文字表达式:。
(4)丙同学:打算用铁丝替代红磷,实验能否成功?请说明理由。。
(5)燃烧后,集气瓶内剩余的气体主要是氮气,请结合本实验推测氮气的物理性质是。发布:2024/11/7 8:0:2组卷:19引用:1难度:0.5


