肌红蛋白(Mb,M=16700g•mol-1)和血红蛋白(Hb,M=64000g•mol-1)分别存在于哺乳动物肌细胞和血液中,通过储存和分配O2维持人体生理活动,其原理为:
反应Ⅰ.Mb(aq)+O2(g)⇌MbO2(aq)ΔH1
反应Ⅱ.Hb(aq)+O2(g)⇌HbO2(aq)ΔH2
(1)设反应Ⅰ平衡时Mb与O2的结合率(即Mb的转化率)为α(Mb),氧气的分压为P(O2),在T=37℃下的α(Mb)~P(O2)、在P(O2)=1kPa下的α(Mb)~T如图1所示:
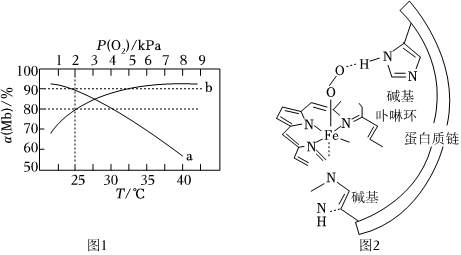
①下列说法正确的是 BDBD。
A.ΔH1>0
B.曲线b为等温线
C.其他条件不变,高烧患者体内的c(MbO2)会比其健康时高
D.其他条件不变,从低海拔地区进入高海拔地区人体内α(Mb)会降低,易有眩晕感
②设反应mA(aq)+nB(g)⇌xC(g)+yD(aq)的标准平衡常数Kθ=(PCPθ)x•(c0cθ)y(PBPθ)n•(cAcθ)m,其中Pθ=100kPa、cθ=1mol•L-1,则37℃时反应Ⅰ的标准平衡常数为 200200。
(2)将1L一定浓度的血红蛋白Hb溶液(比热容约为( 4.2J•g-1•℃-1密度近似为1.0g•cm-3)放入绝热量热计中并充入氧气,当有320gHb被氧化时,测得体系温度升高0.21℃,ΔH2=-176.4-176.4kJ•mol-1。
(3)已知血红蛋白中含有Fe2+卟啉环配合物,其结合O2后的基本结构如图2所示,O2和血红蛋白之间的作用力为 氢键、配位键氢键、配位键。
(4)若人体误食亚硝酸盐,会导致血红蛋白中的Fe2+转化为Fe3+失去载氧能力而中毒,可服用抗坏血酸(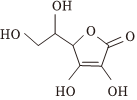 )解毒,抗坏血酸的作用是 将Fe3+还原为Fe2+,恢复载氧能力将Fe3+还原为Fe2+,恢复载氧能力。
)解毒,抗坏血酸的作用是 将Fe3+还原为Fe2+,恢复载氧能力将Fe3+还原为Fe2+,恢复载氧能力。
(5)CO会与血红蛋白结合形成HbCO导致人体中毒:Hb(aq)+CO(g)⇌HbCO(aq)。
①HbCO和HbO2具有相似的结构,但稳定性更强,可能的原因为 CO的配位原子为C,O2的配位原子为O,C的电负性小于O,更易接受孤对电子对形成稳定的配位键CO的配位原子为C,O2的配位原子为O,C的电负性小于O,更易接受孤对电子对形成稳定的配位键。
②从化学平衡角度简述CO的中毒原理:CO与Hb结合,降低血液中Hb的浓度,使反应Ⅱ向逆反应方向移动,Hb与O2的结合率降低CO与Hb结合,降低血液中Hb的浓度,使反应Ⅱ向逆反应方向移动,Hb与O2的结合率降低。
③已知反应HbO2(aq)+CO(g)⇌HbCO(aq)+O2(g)K=220。实验表明,人体内HbCO与HbO2的浓度之比为1:50已足以使人智力受损,则抽烟时吸入肺部的空气中CO与O2的体积比大于 1:110001:11000即达到智力受损的程度。
(
P
C
P
θ
)
x
•
(
c
0
c
θ
)
y
(
P
B
P
θ
)
n
•
(
c
A
c
θ
)
m
【答案】BD;200;-176.4;氢键、配位键;将Fe3+还原为Fe2+,恢复载氧能力;CO的配位原子为C,O2的配位原子为O,C的电负性小于O,更易接受孤对电子对形成稳定的配位键;CO与Hb结合,降低血液中Hb的浓度,使反应Ⅱ向逆反应方向移动,Hb与O2的结合率降低;1:11000
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/8/28 10:0:8组卷:18引用:1难度:0.7
相似题
-
1.氢气最早于16世纪被人工制取出来,氢气是一种清洁能源。
(1)利用光伏电池电解水制H2是氢能的重要来源。已知:H-H键、O=O键、H-O键的键能依次为436kJ•mol-1、495kJ•mol-1、463kJ•mol-1。则2H2O(g)═2H2(g)+O2(g)△H=kJ•mol-1。
(2)T1℃时,向5L恒容密闭容器中充入0.5molCH4,只发生反应2CH4(g)⇌C2H4(g)+2H2(g),达到平衡时,测得c(C2H4)=2c(CH4),CH4的转化率为;保持其他条件不变,温度改为T2℃,经25s后达到平衡,测得c(CH4)=2c(C2H4),则0~25s内v(C2H4)=mol•L-1•s-1。
(3)CH4分解时几种气体的平衡分压(pPa)的对数值lgp与温度的关系如图所示。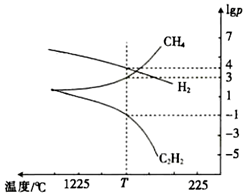
①T℃时,向一恒容密闭容器中通入一定量的CH4(g)、C2H4(g)和H2(g),只发生反应2CH4(g)⇌C2H2(g)+3H2(g)ΔH,ΔH(填“>”或“<”)0,此时的平衡常数Kp=(用平衡分压代替浓度进行计算)Pa2。
②若只改变一个反应条件使Kp变大,则该条件是(填标号)。
A.减小C2H2的浓度
B.升高温度
C.增大压强
D.加入合适的催化剂
(4)工业上,以KNH2和液氨为电解质,以石墨为电极,电解液氨制备H2。阳极的电极反应式为,一段时间后阴、阳两极收集到的气体质量之比为。发布:2025/1/4 8:0:1组卷:9引用:3难度:0.5 -
2.反应 4A(g)+5B(g)⇌4C(g)+6D(g)在 5L 的密闭容器中进行,半分钟后,C 的物质的量增 加了 0.30mol。下列叙述正确的是( )
发布:2024/12/30 19:30:2组卷:67引用:6难度:0.6 -
3.将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)⇌xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率为0.1mol/(L•min).求:
(1)此时A的浓度c(A)=mol/L,反应开始前容器中的A、B的物质的量:n(A)=n(B)=mol;
(2)B的平均反应速率v(B)=mol/(L•min);
(3)x的值为.发布:2024/12/30 19:0:1组卷:163引用:26难度:0.3


