如图1也是一些可用来制取二氧化碳气体的装置,请你分析:

(1)所选用原料组合可以是 大理石或石灰石与稀盐酸大理石或石灰石与稀盐酸。
(2)这个装置的特点是 可以控制反应的发生与停止可以控制反应的发生与停止。
关闭活塞K,出现的现象是 试管中的液面下降,固体逐渐分离,反应停止试管中的液面下降,固体逐渐分离,反应停止。
开启活塞K,出现的现象是 试管中的液面上升,固体与液体接触,反应开始试管中的液面上升,固体与液体接触,反应开始。
(3)按图2装置来制取二氧化碳气体,气体通入盛有滴有紫色石蕊试液的试剂瓶内,溶液的颜色从 紫紫色变 红红色。二氧化碳溶于水生成了 碳酸碳酸,反应的化学方程式为 CO2+H2O=H2CO3CO2+H2O=H2CO3。
(4)取少量试剂瓶内的液体加到小试管内,加热该溶液,溶液的颜色从 红红色,变成 紫紫色。说明碳酸 不稳定不稳定,受热 易分解易分解。反应的化学方程式为 H2CO3 △ CO2↑+H2OH2CO3 △ CO2↑+H2O。
(5)实验室用大理石或石灰石来制取二氧化碳气体,可选用的酸液有:盐酸、硫酸、醋酸等,其中不宜采用的酸是 硫酸硫酸,原因是 硫酸与碳酸钙反应生成微溶于水的硫酸钙,会附着在大理石或石灰石的表面,阻止反应的进一步发生硫酸与碳酸钙反应生成微溶于水的硫酸钙,会附着在大理石或石灰石的表面,阻止反应的进一步发生。
△
△
【答案】大理石或石灰石与稀盐酸;可以控制反应的发生与停止;试管中的液面下降,固体逐渐分离,反应停止;试管中的液面上升,固体与液体接触,反应开始;紫;红;碳酸;CO2+H2O=H2CO3;红;紫;不稳定;易分解;H2CO3 CO2↑+H2O;硫酸;硫酸与碳酸钙反应生成微溶于水的硫酸钙,会附着在大理石或石灰石的表面,阻止反应的进一步发生
△
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/7/26 8:0:9组卷:1引用:2难度:0.6
相似题
-
1.实验室制取气体所需的装置如图所示,请回答以下问题。
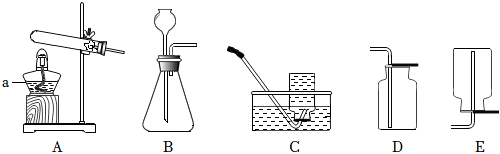
(1)a仪器名称。收集氧气可以选用C,原因是。用高锰酸钾制氧气,反应的化学方程式为。
(2)实验室用石灰石和稀盐酸制取CO2,发生装置应选用,收集用,CO2的验满方法为。发布:2024/12/8 10:30:2组卷:50引用:4难度:0.5 -
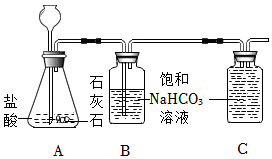 2.实验室可用如图装置制取二氧化碳;已知常温下CO2滩溶于饱和NaHCO3溶液。
2.实验室可用如图装置制取二氧化碳;已知常温下CO2滩溶于饱和NaHCO3溶液。
(1)写出A装置中发生反应的化学方程式。
(2)B中饱和碳酸氢钠溶液的作用是什么?
(3)利用排饱和NaHCO3溶液法可以收集较纯净的二氧化碳气体,请将C装置中的导管补画完整。发布:2024/12/25 15:0:2组卷:7引用:2难度:0.6 -
3.用图-1所示装置制取干燥的CO2,并对CO2的部分性质进行探究。
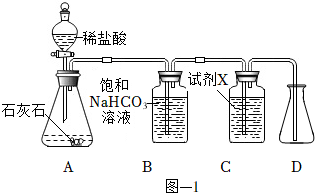
(1)装置A中发生反应的化学方程式为。
(2)①装置B中饱和NaHCO3溶液的作用是。
②装置C中试剂X应该选用(填字母)。
a.稀H2SO4
b.浓H2SO4
c.KOH溶液
(3)收集CO2并验满。将集满CO2的锥形瓶与盛有足量NaOH溶液的注射器和传感器密封连接,缓慢的将NaOH溶液注入到锥形瓶中,采集信息形成图像。见图-2。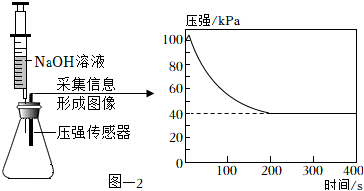
①检验装置D中CO2已经集满的方法是。
②随着反应的进行,锥形瓶中压强降低的原因是。
③反应结束后锥形瓶中的压强保持在40kPa说明。
(4)取2mL饱和澄清石灰水于试管中,用4mL蒸馏水稀释,向其中缓慢通入足量CO2。测定反应体系的电导率变化如图-3所示。(忽略反应前后溶液体积的变化)
【查阅资料】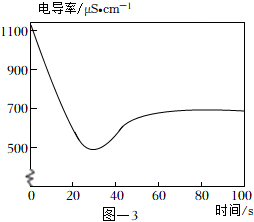
材料一:溶液的导电能力越强,溶液的电导率越大。
材料二:单位体积溶液中某离子的个数越多,则该离子的浓度越大,溶液的导电能力越强。相同浓度的不同离子导电能力不同。
材料三:Ca( OH)2溶于水能完全解离出Ca2+和OH-。
CaCO3遇到溶有CO2的水时,能反应生成易溶于水的Ca( HCO3)2,Ca( HCO3)2在水中能完全解离出Ca2+和。HCO-3
①石灰水中通入CO2气体,溶液的电导率先逐渐降低的主要原因是。
②反应最终电导率的稳定值低于初始值的可能原因是、。发布:2024/12/25 13:0:1组卷:841引用:3难度:0.6


