能源既是国家经济发展的命脉,也是国家发展战略的重要支柱。氢气被看做是理想的“绿色能源”,氢气的制备及应用是目前的研究热点。
Ⅰ、氢气的制备
(1)铁酸锌(ZnFe2O4)可用于催化循环分解水制取氢气,其中涉及的反应有:
a:6ZnFe2O4 1200℃ 6ZnO+4Fe3O4+O2↑
b:3ZnO+2Fe3O4+H2O 700℃ 3ZnFe2O4+H2↑
该循环制氢的总化学反应方程式为 2H2O ZnFe2O4 高温2H2↑+O2↑2H2O ZnFe2O4 高温2H2↑+O2↑。
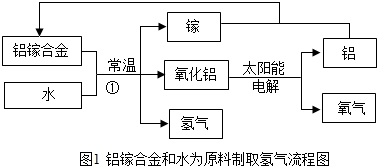
(2)科学家研发出一种以铝镓合金(镓:Ga)和水为原料制取氢气的新工艺,流程如图1所示:反应①的化学方程式是 2Al+3H2O Ga Al2O3+3H2↑2Al+3H2O Ga Al2O3+3H2↑,与电解水制取氢气相比,用铝镓合金和水为原料制取氢气的优点是 常温下反应,节约能源等常温下反应,节约能源等。(答出一点即可),该流程中可循环利用的物质是 铝和镓铝和镓。
(3)利用甲烷(CH4)和水蒸气催化重整制氢,主要在500℃以上发生下列反应:
a:CH4+H2O 催化剂 高温CO+3H2;b:CO+H2O 催化剂 高温CO2+H2。
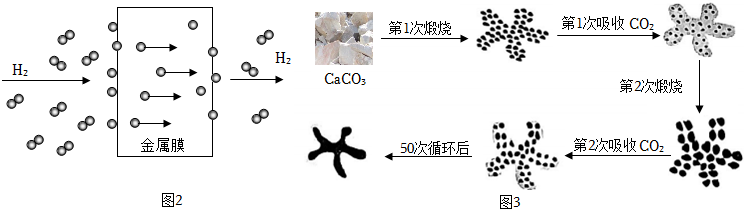
①提纯氢气的方法之一是使用金属膜透氢,微观过程如图2所示,从微观角度描述该过程 氢分子在金属膜表面分解为氢原子,氢原子通过金属膜后重新组合成氢分子氢分子在金属膜表面分解为氢原子,氢原子通过金属膜后重新组合成氢分子。
②提纯氢气还可以用CaO作为吸附剂吸收除去CO2,使用一段时间后氧化钙会转化为碳酸钙而失效。失效的吸附剂经煅烧可再次投入使用,但经多次循环后,吸附效果仍会降低。固体结构变化如图3所示,请分析吸附剂效果降低的原因是 随着煅烧次数的增加,生成氧化钙的孔洞逐渐减少,吸附效果减弱随着煅烧次数的增加,生成氧化钙的孔洞逐渐减少,吸附效果减弱。
Ⅱ、氢气的储存
(4)储氢金属是一类能够与H2结合呈金属氢化物的材料,如Na可与H2结合生成氢化钠(NaH),氢化钠与水反应可释放出H2,同时生成一种碱,该反应的化学方程式为 2Na+2H2O=2NaOH+H2↑2Na+2H2O=2NaOH+H2↑。
Ⅲ、氢能的应用
(5)利用“活泼金属”可以制得氢气,氢气可用作汽车能源。若推广应用于汽车产业,则需综合考虑的因素有 ABCABC(填字母)。
A.金属原料的成本
B.生成过程中的能耗和污染
C.金属的回收利用
1200
℃
700
℃
Z
n
F
e
2
O
4
高温
Z
n
F
e
2
O
4
高温
G
a
G
a
催化剂
高温
催化剂
高温
【答案】2H2O 2H2↑+O2↑;2Al+3H2O Al2O3+3H2↑;常温下反应,节约能源等;铝和镓;氢分子在金属膜表面分解为氢原子,氢原子通过金属膜后重新组合成氢分子;随着煅烧次数的增加,生成氧化钙的孔洞逐渐减少,吸附效果减弱;2Na+2H2O=2NaOH+H2↑;ABC
Z
n
F
e
2
O
4
高温
G
a
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/5/23 8:0:8组卷:128引用:4难度:0.5
相似题
-
1.新冠肺炎疫情防控期间,西安市各学校开展全域喷洒低浓度、有效成分是次氯酸钠的“84”消毒液进行消毒。如图所示是模拟制备“84”消毒液的流程(Cl2是一种黄绿色的有毒气体)。请回答下列问题:
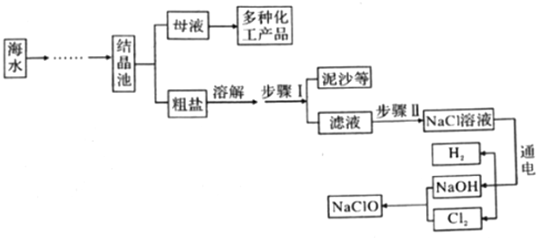
(1)NaOH的俗称为(写一种)。
(2)步骤Ⅱ中,通常用碳酸钠溶液除去滤液中的氯化钙杂质,请写出有关反应的化学方程式。
(3)电解水时,一般在水中加入少量NaOH以增强水的导电性,不能加入NaCl的原因是。发布:2025/1/3 8:0:1组卷:6引用:1难度:0.5 -
2.某种家用的消毒液的主要成分是次氯酸钠(NaClO),制取NaClO的化学方程式为:Cl2+2NaOH=NaClO+NaCl+H2O,下列说法错误的是( )
发布:2025/1/3 8:0:1组卷:71引用:1难度:0.7 -
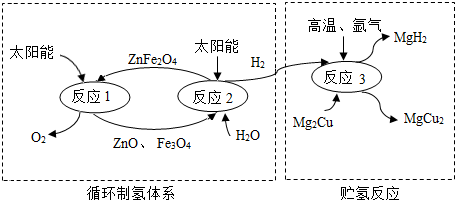 3.如图是制取与贮存氢气的一种方法,Mg2Cu是一种贮氢合金,吸氢后生成MgH2和MgCu2合金的混合物(M),MgH2+2HCl═MgCl2+2H2↑,下列说法不正确的是( )发布:2024/12/31 8:0:1组卷:48引用:2难度:0.5
3.如图是制取与贮存氢气的一种方法,Mg2Cu是一种贮氢合金,吸氢后生成MgH2和MgCu2合金的混合物(M),MgH2+2HCl═MgCl2+2H2↑,下列说法不正确的是( )发布:2024/12/31 8:0:1组卷:48引用:2难度:0.5


