大量燃放鞭炮会引起空气中SO2等有害气体含量增高,造成大气污染。某兴趣小组欲探究SO2的性质,并利用SO2制备食品抗氧化剂焦亚硫酸钠(Na2S2O5)。已知Na2S2O5溶于水即生成NaHSO3。
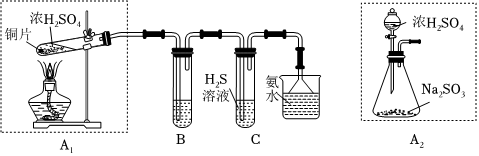
(1)制取SO2并探究其性质
①装置A1中发生反应的化学方程式为 Cu+2H2SO4(浓) △ CuSO4+SO2↑+2H2OCu+2H2SO4(浓) △ CuSO4+SO2↑+2H2O。
②装置B用于检验SO2的漂白性,其中所盛试剂为 品红溶液品红溶液,装置C中发生反应的SO2和H2S的物质的量之比为 1:21:2。
③为了实现绿色环保的目标,甲同学欲用装置A2代替装置A1,你认为装置A2除具有绿色环保的优点外,还具有的优点是 不用加热(或节约能源)相对安全;易于控制反应进行等不用加热(或节约能源)相对安全;易于控制反应进行等(任写一点)。
(2)制备焦亚硫酸钠并测定其含量
①将SO2通入Na2SO3制取Na2S2O5,发生的反应为Na2SO3+SO2=Na2S2O5,该反应为 非氧化还原反应非氧化还原反应(填“氧化还原反应”或“非氧化还原反应”)。
②测定某葡萄酒中Na2S2O5残留量的方案为:取葡萄酒样品100.00mL,加入盐酸充分蒸馏。将馏分用0.0100mol/L标准I2溶液进行滴定(反应方程式为SO2+I2+2H2O=H2SO4+2HI),消耗标准I2溶液25.00mL。计算样品中抗氧化剂的残留量(以SO2计)为 0.160.16g⋅L-1(写出计算过程)。
△
△
【考点】二氧化硫的性质.
【答案】Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O;品红溶液;1:2;不用加热(或节约能源)相对安全;易于控制反应进行等;非氧化还原反应;0.16
△
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/5/30 8:0:9组卷:96引用:1难度:0.7


