Ⅰ.阅读、分析下列两个材料:
材料一

材料二
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g/cm3 | 溶解性 |
| 乙二醇(C2H6O2) | -11.5 | 198 | 1.11 | 易溶于水和乙醇 |
| 丙三醇(C3H8O3) | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比互溶 |
(1)从含少量NaCl的Na2CO3中提纯Na2CO3的操作为溶解、
蒸发浓缩
蒸发浓缩
、冷却结晶
冷却结晶
、过滤、洗涤、干燥;证明碳酸钠晶体已洗涤干净的操作是:取最后一次洗涤滤出液,滴加硝酸银和稀硝酸,无白色沉淀,则已洗涤干净
取最后一次洗涤滤出液,滴加硝酸银和稀硝酸,无白色沉淀,则已洗涤干净
。(2)将乙二醇和丙三醇相互分离的最佳方法是
A
A
。A.蒸馏法
B.萃取法
C.结晶法
D.分液法
Ⅱ.青蒿素是最好的抵抗疟疾的药物,可从黄花蒿茎叶中提取,它是无色针状晶体,可溶于乙醇、乙醚等有机溶剂,难溶于水。常见的提取方法如下:

(3)操作Ⅰ、Ⅱ中,不会用到的装置是
C
C
(填序号)。
Ⅲ.实验室用98%、密度为1.84g/cm3的浓硫酸配制0.2mol/L的H2SO4溶液470mL。
(4)需要使用的主要仪器有量筒、烧杯、玻璃棒、
胶头滴管
胶头滴管
、500mL容量瓶
500mL容量瓶
。(5)其操作步骤可分解为以下几步:
A.用量筒量取
5.4
5.4
mL浓硫酸,缓缓注入装有约50mL蒸馏水的烧杯里,并用玻璃棒搅拌。B.用适量蒸馏水分三次洗涤烧杯和玻璃棒,将每次的洗液都移入容量瓶里。
C.将稀释后的硫酸小心地用玻璃棒引流容量瓶里。
D.检查容量瓶是否漏水。
E.将蒸馏水直接加入容量瓶,至液面接近刻度线1~2cm处。
F.盖紧瓶塞,反复颠倒振荡,摇匀溶液。
G.用胶头滴管向容量瓶里逐滴加入蒸馏水,到液面最低点恰好与刻线相切。
请据此填写:
①完成上述步骤中的空白处。
②补充完成正确的操作顺序(用字母填写):(D)→(A)→
C
C
→B
B
→E
E
→G
G
→(F)。(6)下列操作会使所配稀硫酸浓度偏高的是
AD
AD
。A.取用浓硫酸时仰视刻度线
B.转移溶液时,不慎有少量溶液洒出
C.定容时仰视容量瓶刻度线
D.将稀释后的稀硫酸立即转入容量瓶且进行后面的实验操作
E.定容后倒置摇匀,正放后发现液面低于刻度线,又补充几滴蒸馏水至刻度线
【答案】蒸发浓缩;冷却结晶;取最后一次洗涤滤出液,滴加硝酸银和稀硝酸,无白色沉淀,则已洗涤干净;A;C;胶头滴管;500mL容量瓶;5.4;C;B;E;G;AD
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/10/9 3:0:1组卷:6引用:1难度:0.7
相似题
-
1.分离乙酸乙酯、乙醇、乙酸的混合物,可按下列步骤进行:
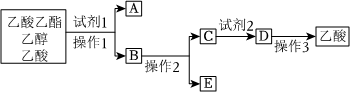
(1)试剂1最好选用。
(2)操作1是,所用的主要仪器名称是。
(3)操作2是。
(4)试剂2最好选用。
(5)有同学认为乙酸在温度低于16.6℃时会凝结成晶体,因此可通过降温的方法使乙酸结晶而分离出来,操作3是结晶、过滤,这一看法是否正确?为什么?发布:2024/12/30 14:30:1组卷:15引用:5难度:0.4 -
2.化学家从反应C2H6(g)+Cl2(g)→C2H5Cl(l)+HCl(g)中受到启发,提出在农药和有机合成工业中可获得副产品盐酸,这一设想已成为现实.试指出从上述反应体系中得到盐酸可采用的分离方法是( )
发布:2024/12/30 9:30:2组卷:25引用:3难度:0.9 -
3.苯甲酸的重结晶实验基本操作如下:
①将粗苯甲酸1g加到100mL的烧杯中,再加入50mL蒸馏水,在石棉网上边搅拌边加热,使粗苯甲酸溶解,②全溶后再加入少量蒸馏水并搅拌.③然后,使用短颈玻璃漏斗趁热将溶液过滤到另一100mL烧杯中,将滤液静置,使其缓慢冷却结晶.④滤出晶体.回答下列问题:
(1)上述四步操作过程中需用到玻璃棒的步骤有
(2)步骤②的目的是;
(3)观察滤液冷却时的实验现象:;
(4)重结晶后苯甲酸的状态:.发布:2024/12/30 8:30:1组卷:45引用:4难度:0.5


