如图1所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙烧杯中X为阳离子交换膜。请按要求回答相关问题:
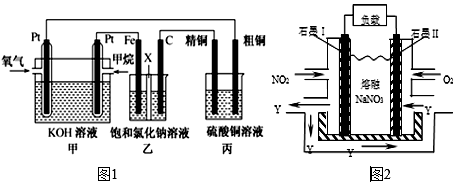
(1)甲烷燃料电池负极电极反应式是CH4+10OH--8e-=CO32-+7H2OCH4+10OH--8e-=CO32-+7H2O;正极电极反应式是O2+2H2O+4e-=4OH-O2+2H2O+4e-=4OH-
(2)石墨(C)为阳阳极,其电极反应式为2Cl--2e-=Cl2↑;2Cl-+2H2O2Cl--2e-=Cl2↑;2Cl-+2H2O;乙中总反应的离子方程式为2Cl-+2H2O 2OH-+H2↑+Cl2↑2Cl-+2H2O
2OH-+H2↑+Cl2↑2Cl-+2H2O 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
(3)若在标准状况下,有2.24L氧气参加反应,则丙装置中阴极析出铜的质量为12.812.8g;
(4)若将甲装置中的甲烷换成甲醇(CH3OH),KOH溶液换成稀硫酸,则负极电极反应式为CH3OH-6 e-+H2O=CO2+6H+CH3OH-6 e-+H2O=CO2+6H+,消耗等量氧气时,需要甲烷与甲醇的物质的量之比为3:43:4。
(5)NO2、O2和熔融NaNO3可制作燃料电池,其原理见图2,该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应式为NO2+NO3--2e-=N2O5NO2+NO3--2e-=N2O5。
 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑ 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑【考点】原电池与电解池的综合;电解原理.
【答案】CH4+10OH--8e-=CO32-+7H2O;O2+2H2O+4e-=4OH-;阳;2Cl--2e-=Cl2↑;2Cl-+2H2O;2Cl-+2H2O 2OH-+H2↑+Cl2↑;12.8;CH3OH-6 e-+H2O=CO2+6H+;3:4;NO2+NO3--2e-=N2O5
2OH-+H2↑+Cl2↑;12.8;CH3OH-6 e-+H2O=CO2+6H+;3:4;NO2+NO3--2e-=N2O5
 2OH-+H2↑+Cl2↑;12.8;CH3OH-6 e-+H2O=CO2+6H+;3:4;NO2+NO3--2e-=N2O5
2OH-+H2↑+Cl2↑;12.8;CH3OH-6 e-+H2O=CO2+6H+;3:4;NO2+NO3--2e-=N2O5【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/8/16 9:0:1组卷:19引用:2难度:0.6